Anticoncepción y cáncer de mama: los sí y lo no en esta compleja situación

Dra. María Elisa Moltoni1
Médica tocoginecóloga
Htal. Británico de Buenos Aires y Halitus instituto médico
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
1. INTRODUCCIÓN
1.1. Definiendo el problema
El cáncer de mama (CM) es uno de los tumores más frecuentes en la mujer. Si bien se asocia a priori con mujeres de edad avanzada en menopausia, debemos decir que una proporción considerable, del 25 al 30%, de las mujeres afectadas por cáncer de mama, son premenopáusicas.1 Es más, un 5% de ellas son menores de 40 años. En cuanto a su fertilidad o desde el punto de vista de la medicina reproductiva, la mayoría de pacientes de ese grupo están en sus últimos años de vida reproductiva, con una media de 36 a 37 años. Sin embargo, si bien no es un grupo extenso de pacientes, dada la alta frecuencia de este tumor en la población general, esta situación cobra relevancia.
Se dice que en esta población de mujeres pre menopáusicas con cáncer de mama el uso de métodos anticonceptivos es heterogéneo e insuficiente. Esto lleva a un alto riesgo de embarazo no planificado, agravado por la imposibilidad de usar anticoncepción hormonal en estas mujeres.2
Las sobrevivientes de cáncer, en general, usan métodos anticonceptivos menos efectivos y tendrían mayores tasas de embarazo no planificado y de aborto.3 Sin embargo, y a pesar de eso, un 67% de sobrevivientes jóvenes con CM siguen siendo fértiles.4
El objetivo de la presente revisión es indagar en la necesidad anticonceptiva de mujeres jóvenes con cáncer de mama evaluando la evidencia sobre qué métodos anticonceptivos pueden o no utilizar. Además se pretende brindar estrategias para evitar embarazos no planificados en este grupo de pacientes.
1.2. Maternidad luego del diagnóstico de cáncer de mama
Dado que esta revisión aborda el tema de anticoncepción, debemos hacer referencia a lo recomendado acerca de cuanto esperar para buscar embarazo luego del tratamiento por CM. En general se recomienda esperar dos años, evitando de ese modo el embarazo durante el período con mayor posibilidad de recurrencia.
No habría riesgo de teratogenicidad con el antecedente previo de CM, pero sí puede existir teratogenicidad durante el tratamiento así como mayor tasa de aborto.5 Están descriptas malformaciones con quimioterapia y radioterapia administradas en el primer trimestre de embarazo. En cuanto a otros tratamientos previos a la búsqueda de embarazo se recomienda esperar 3 meses posteriores a la finalización del tamoxifeno, así como 7 meses post finalización de trastuzumab.6
1.3. Embarazos post cáncer de mama
Los embarazos posteriores al CM de todas maneras no son muy frecuentes. Esto está dado por las alteraciones de la fertilidad propias de la gonadotoxicidad de la quimioterapia, así como por el retraso “médicamente recomendado” de la gestación. También se explica esto porque la misma paciente evita la gestación luego del tratamiento por temores (a la recurrencia, preocupaciones por posibilidad de muerte, etc.).
En embarazos posteriores al CM no habría compromiso de la supervivencia de la mujer. En el 2011 un metaanálisis de 14 estudios caso control evaluó el impacto del embarazo en la supervivencia global de mujeres con CM. Se observó que aquellas con embarazos tenían una reducción de 40% de riesgo de muerte. Esto se ha atribuido en parte a un posible sesgo de selección llamado “healthy mother effect”, o efecto de la madre sana, donde en realidad serían las mujeres con mejor pronóstico per se y curadas, las que se embarazan, ya que son capaces de concebir y sobrellevar un embarazo.7
Debemos saber que a pesar de que tengamos por ejemplo una paciente amenorreica, esa amenorrea no es sinónimo de infertilidad y muchas veces, según la edad de la paciente, puede haber un retorno de los ciclos menstruales, asimismo de su capacidad fértil post tratamiento que debemos tener en cuenta.
2. Desarrollo
2.1. Consejería sobre anticoncepción en mujeres jóvenes con CM y rol del oncólogo
Un estudio nos ilustra sobre el rol del oncólogo en la consejería anticonceptiva de mujeres jóvenes con CM. En dicho estudio, mezcla de retrospectivo con encuesta, se analizó en principio la historia de 100 pacientes con diagnóstico de CM menores de 40 años (7,7% de la población de CM en la institución de los autores) entre 1990 y 2007. Además se tomó una encuesta a oncólogos en Suiza, Alemania y Austria, con 4 preguntas sobre anticoncepción en pacientes jóvenes con CM.2 Lo llamativo es que más del 90 % de los profesionales manifiesta que la anticoncepción es un aspecto importante en mujeres jóvenes con CM y le advierten antes de comenzar el tratamiento que deben evitar el embarazo por uno o dos años. Sin embargo, sólo 45% manifiesta “raramente” preguntar en forma activa sobre el uso de anticoncepción durante el tratamiento de quimio o radioterapia o durante el primer año post diagnóstico y sólo 41% deriva a un ginecólogo.
En la parte retrospectiva de este estudio se observa que un 62% de las pacientes necesitaba un método anticonceptivo (MAC) porque o bien no utilizaban ninguno, o utilizaban uno ineficaz. Sería razonable pensar que en la consulta con el oncólogo queda poco espacio para tocar este tema, dado que el tiempo se invierte en hablar sobre el diagnóstico y tratamiento del CM. Esto refleja la necesidad de aprender a derivar y trabajar en forma multidisciplinaria, porque el oncólogo o mastólogo muchas veces tampoco será el profesional más apropiado para hablar de asesoramiento anticonceptivo. No basta simplemente con preguntar por uso de un MAC, debemos asegurarnos que la paciente lo utilice y facilitar que esto ocurra.
Enfatizan los autores que, al diagnóstico de CM, si la paciente se encuentra utilizando un método hormonal, no se suspenda el método hasta que no se asegure otro MAC efectivo. Podría ser más peligroso, según ellos, que la paciente quede embarazada en un prequirúrgico o pre tratamiento.2
2.2. Fallas típicas de la AC en cáncer de mama
En otro trabajo de Güth y colaboradores, se realiza un seguimiento de una cohorte de 100 pacientes jóvenes con CM durante el primer año del diagnóstico, a fin de descubrir fallas típicas en la anticoncepción de estas pacientes. Se consideró que un 58% tenía riesgo de embarazo (las que no se consideraban en riesgo por ejemplo eran aquellas con DIU o ligadura tubaria). En esta cohorte, con un promedio de 36,5 años, se produjeron dos embarazos. Esto arroja que el porcentaje de embarazo en este grupo “de riesgo” del 3,5%, lo cual no es despreciable en el contexto de una mujer con CM.8 ¿Adónde podríamos fallar al asesorar a la paciente? En asumir una baja probabilidad de embarazo por estar la mujer es sus últimos años de vida reproductiva; por asumir que está usando un MAC, sin cuestionarnos que éste puede ser de baja eficacia y por pensar que si está en amenorrea la mujer no puede quedar embarazada.
Con respecto a la amenorrea durante la quimioterapia en un estudio se observó que un 85% de las pacientes premenopáusicas recibiendo 4 dosis de QT (doxorrubicina, ciclofosfamida y paclitaxel) retomaron su menstruación en 12 meses, la mayoría dentro de los 6 primeros meses.9 Sabemos que la menstruación no indica fertilidad, pero tampoco la amenorrea garantiza esterilidad.
2.3. Fallas en la indicación o mala indicación del MAC
En cuanto a AC en mujeres con CM podemos encontrarnos al otro extremo de la no indicación de un MAC post diagnóstico: la indicación de un MAC incorrecto. Por ejemplo en un estudio francés, retrospectivo, de 197 pacientes con diagnóstico de CM, Hamy 10 observó que a un 21% de ellas se les había indicado post diagnóstico de CM un MAC hormonal, en general progestinas, a pesar de que es sabido que los métodos hormonales no suelen ser recomendados en CM, según veremos en los siguientes apartados de este trabajo. Al resto de las mujeres, se les indicó DIU en mayor proporción.
2.4. MACs en la paciente con cáncer de mama actual o pasado
a. Criterios de elegibilidad
La organización mundial de la salud (OMS) presenta a través de reuniones de expertos análisis sobre el uso de los diferentes métodos anticonceptivos en variadas situaciones clínicas tanto de normailidad como de patologías crónicas. En base a ello se conforman recomendaciones sobre el uso de métodos anticonceptivos, asignándole categoría 1 y 2 a aquellos métodos que pueden usarse en cierto grupo de mujeres, y categoría 3 y 4 a aquellos que no se recomienda utilizar.
En base a duchas recomendaciones, la OMS dice que en ausencia de estudios prospectivos, recomienda evitar los métodos hormonales en pacientes con CM actual o pasado.11
Las opciones anticonceptivas que pueden utilizar sin restricciones las pacientes con CM actual o pasado son: preservativo, diafragma, DIU de Cobre y métodos quirúrgicos. De primera elección, deberían ser los métodos quirúrgicos como ligadura tubaria y vasectomía y el DIU de Cobre, porque tienen una eficacia superior a los otros métodos. En pacientes con paridad cumplida o con riesgo genético comprobado, puede ofrecerse la salpingectomía bilateral o la salpingooforectomía bilateral de reducción de riesgo. Dicha cirugía, una nueva tendencia internacional, postula la extirpación de las trompas para lograr una fuerte reducción del riesgo de cáncer de ovario en la población general.12

Si evaluamos los criterios de elegibilidad de diferentes organismos incluyendo la OMS (2015) 11, el CDC (2016)13, FSRH (UKMEC 2016)14 con respecto al uso de métodos hormonales en una mujer con cáncer de mama actual o pasado, podemos decir que según estos criterios de elegibilidad, todos los métodos hormonales son:
- Categoría 4 para cáncer de mama actual.
- Categoría 4 significa que usar el método es un riesgo inaceptable para la salud si se utiliza el método
- Categoría 3 para cáncer de mama hace más de 5 años.
- Categoría 3 significa que los riesgos teóricos o comprobados del método son mayores que las ventajas
El CM es hormonosensible y el pronóstico de la mujer con CM actual o reciente puede empeorar con el uso de AC combinada o de sólo progestágenos
La preocupación por la progresión de la enfermedad puede ser menor con el SIU que con ACH combinados o prostágenos, con dosis mayores
Cuando decimos métodos hormonales vale aclarar que nos referimos a: anticonceptivos orales combinados, anillo vaginal, anticonceptivos inyectables combinados y parches. Se incluyen también los métodos de solo progestágenos como las píldoras de solo progestágenos (POP), el AMPD (acetato de medroxiprogesterona de depósito), el implante de etonorgestrel y el SIU o sistema intrauterino liberador de levonorgestrel. Los métodos con progestágenos solos están por lo tanto, también contraindicados según los criterios de elegibilidad.
En cuanto a la OMS y al CDC, realizan al referirse a criterios, ciertas aclaraciones para una mejor compresión de cada criterio. En cuanto al uso de métodos hormonales aclaran que “El CM es hormonosensible y el pronóstico de la mujer con CM actual o reciente puede empeorar con el uso de AC combinada o de sólo progestágenos” y con respecto al SIU de levonorgestrel (SIU-LNG) manifiestan: “la preocupación por la progresión de la enfermedad puede ser menor con el SIU que con ACH combinados o progestágenos con dosis mayores”. Sin embargo, a pesar de esta aclaración en cuanto a SIU, contraindican su uso. (Ver cuadro). Con respecto a este tema nos explayaremos en otra sección.


Internacionalemente también muy conocidos son los Criterios de elegibilidad del Reino Unido (UKMEC por sus siglas en inglés), de la Faculty of Sexual and Reproductive Health. En estos criterios también se analiza el antecedente de cáncer de mama pero como particularidad además suman la categoría de “portadoras de mutación genética conocida asociada al cáncer de mama (ej. BRCA1/2)”. Según estos criterios (ver gráfico) las mujeres con mutación genética conocida no podrían utilizar anticonceptivos hormonales combinados, aunque no hubieran desarrollado un cáncer, dado que le asignan la categoría 3. Sí podrían utilizar estas mujeres métodos con sólo progestágenos como píldoras, implante o SIU.

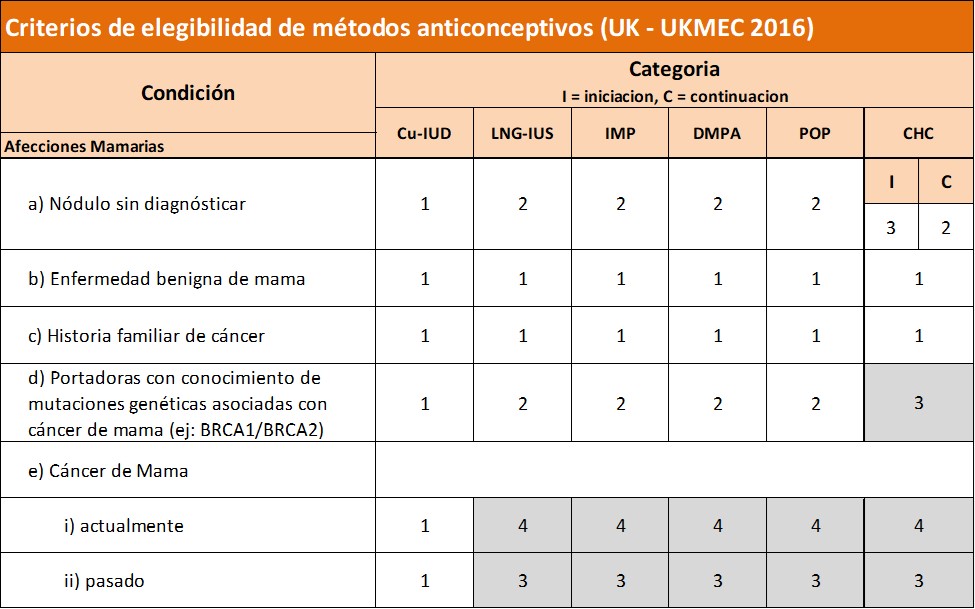
UKMEC también tiene su apartado de aclaraciones y evidencia. En el mismo hablan de “evidencia limitada sobre anticoncepción hormonal en portadoras de mutaciones o con alto riesgo familiar”, de allí probablemnte la contraidicación de usarlos, tal vez más por escasez de evidencia que por evidencia en contra de su uso. Sugiere, en cuanto a población general que el riesgo de CM probablemente NO se modifica con anticoncepción hormonal. Con respecto al SIU, contraindicado en gral con antecedente de CM, abren una posibilidad de uso diciendo que “el uso del SIU por motivos ginecológicos puede considerarse en casos individuales, de acuerdo con el equipo de oncólogos”. En cuanto a anticoncepción de emergencia en CM: lo ubican como categoría 2, es decir sin restricciones para su uso, aclarando que si bien es hormonal los beneficios de su uso claramente superan a los riesgos.
La Society of family planning (SPF) tiene una guía de Cáncer y anticoncepción, publicada en 2012. Sugieren al DIU de cobre como primera línea de anticoncepción en mujeres con historia de CM (Nivel A de recomendación). 12 Aunque en mujeres tratadas con tamoxifeno, el SIU de LNG podría ser preferible por efectos beneficiosos sobre endometrio, reconocen la falta de información disponible asociada al riesgo de recurrencia del CM con SIU. También remarcan la falta de evidencia sobre el riesgo de los anticonceptivos hormonales en pacientes con antecedente de irradiación torácica. En mujeres con CM, tampoco recomiendan progestinas y estrógenos exógenos por preocupación sobre una posible recurrencia asociada. Existe carencia de información sobre cómo el uso de anticoncepción con estrógenos afectaría la tasa de recurrencia, algo bastante esperable dada la imposibilidad de hacer estudios controlados sobre el tema. Si bien el rol de favorecer la carcinogénesis ha recaído tradicionalemnte en los estrógenos (algo en revisión), las progestinas no serían “tan inocentes” al respecto. El rol de las mismas en CM está poco estudiado, pero en modelos animales se ha visto, por ejemplo, que han aumentado las mestástasis. 15,16
La guía de la SPF12 que hemos nombrado antes, aclara que no recomiendan progestinas sistémicas con antecedente de CM, si bien, en la población general, no parecería haber aumento del CM. La contraidicación de la progestinas sistémicas va en línea con lo expresado en los diferentes criterios de elegibilidad.
Luego de este análisis que hemos hecho revisaremos alguna evidencia particular sobre cada tópico relacionado a anticonceptivos en mujeres con antecedente de cáncer de mama.
b. Anticoncepción hormonal combinada y cáncer de mama
Los estudios disponibles hablan en su mayoría de riesgo de CM de población general expuesta a anticoncepción hormonal. Hay carencia de evidencia sobre pacientes con cáncer de mama y uso ulterior de anticoncepción hormonal. No hay evidencia, pero en general se desaconseja el uso como hemos visto en los apartados anteriores.
Existe un subgrupo especial de mujeres que son aquellas con mutación conocida asociada a predisposición al cáncer de mama. Es decir, tal vez no han tenido diagnóstico de cáncer en determinado momento pero tienen por su mutación una impotante predisposición. ¿Debemos tomar a ese grupo de pacientes como población general y se les indica con tranquilidad un anticonceptivo hormonal? Es dificil desconocer esa predisposición e indicar un método hormonal, pero sabemos que con los ACH se gana protección sobre el cáncer de ovario, para el cual no contamos con screening válido para reducción de mortalidad. Los UKMEC vimos que contraindican los métodos hormonales combinados en este subgrupo. La OMS no expone un criterio al respecto de estas pacientes con mutaciones. 17,18,19
c. Progestágenos y cancer de mama
Este artículo se focaliza en mujeres con antecedente de CM. Sin embargo es imposible no pensar en qué efecto produce determinada hormona en población general expuesta a la misma con respecto al aumento de CM. Con respecto al efecto de los progestágenos, en una importante revisión que reúne 217.365 pacientes con 12.189 casos de CM, no encontraron evidencia de que las progestinas aumenten el riesgo de CM. Se incluyeron 6 artículos entre 2000 y 2015. 20
Los autores remarcan de todas maneras que los tamaños muestrales son bajos y que se necesitan futuras investigaciones para comprobarlo. Cinco de 6 artículos de la revisión no encuentran asociación.
En cuanto a inyectable de gestágenos e implante de gestágenos, Strom y col. en 2004 publican sobre estos anticonceptivos. En un grupo de 4575 mujeres con CM invasor no observaron evidencia de aumento del riesgo de CM en pre y postmenopáusicas expuestas a los mismos.21 En el estudio de Fabre22 no encuentran asociación en general, pero sí observan un aumento significativo en el subgrupo de mujeres usuarias actuales de progestinas orales por más de 4,5 años de uso continuo, indicando tal vez una asociación con el tiempo de uso, dado que no obervan aumento en usuarias de menor tiempo.
La relación entre progestágenos y tejido mamario es compleja y a veces contradictoria, si bien los estrógenos han sido considerados los carcinogénicos sabemos que las progestinas no son carentes de efecto sobre la glándula. 23
Pero este efecto es sumamente complejo y por lo tanto difícil de estudiar, ya que no todas las moléculas actuarán de la misma manera. Sabemos que las progestinas pueden tener efecto neutral, proliferativo o antiproliferativo sobre la mama. A su vez ese efecto puede variar según el tiempo de exposición y el “timing”. Los estudios en animales muestran resultados conflictivos.24 Ruan, por ejemplo, observó como progestágenos del mismo grupo pueden ejercer efecto en diferentes receptores (receptores de andrógenos, de glucocorticoides, de mineralocorticoide, de estrógenos: RA, RGC, MC, ER). Además del RP (Receptor de progesterona clásico), puede actuar sobre receptores de progesterona de membrana (PGRMC1). Esto podría explicar en parte tan diferentes efectos de los progestágenos.25
¿Qué sucede con el Acetato de medroxiprogesterona de depósito (AMPD)? Realmente ha existido debate sobre riesgo de CM con este compuesto. Por lo pronto es dentro de los anticonceptivos de sólo progestágenos aquel que alcanza las dosis más altas sistémicas. En animales se observó aumento de CM en perros beagle. Se aprueba en EEUU en 1997, luego de dos grandes estudios colaborativos: Paul en N. Zelanda y WHO, donde observan que no aumentaba el riesgo de CM en general, con aumentos leves con el uso reciente y prolongado. Strom, en un trabajo que mencionamos antes, tampoco encuentra aumento de riesgo de CM.21, 26,27 El desafío es como aplicar esta información en pacientes con antecedente personal de cáncer de mama. Sabemos que por dicho antecedente la paciente ya tiene riesgo de recurrencia per se, por ende cualquier aumento del riesgo con progestágenos (si existiera) sería despreciable comparado a éste. Pero, según analiza la guía canadiense 24, desde el punto de vista de la paciente, es razonable que no quiera tomar ese potencial riesgo de aumento de recurrencia por mínimo que fuese. Concluyen entonces que para la población general el uso de AMPD no aumenta el riesgo de CM (recomendación II-2). En pacientes con CM: se considera el uso de AMPD si los beneficios anticonceptivos o no anticonceptivos superan a los riesgos de recurrencia (III-C). Por otro lado el AMPD a altas dosis ha sido utilizado como adyuvancia en CM avanzado o recurrente. Idealmente entonces, deberíamos elegir métodos no hormonales.
d. Píldoras de solo progestágenos
Con respecto a las píldoras de sólo progestágenos hay poca información disponible en la literatura, en parte porque representan pocas usuarias con respecto a los anticonceptivos hormonales combinados. En principio parece improbable el aumento de riesgo de CM con estos compuestos 28, pero como exponen a dosis considerables de progestágenos, es prudente evitarlas en mujeres con CM. En estas pacientes deberían utilizarse sólo si los beneficios superan a los riesgos (III-C).
e. DIU de cobre
Es unos de los métodos de elección en mujeres con antecedente de cáncer de mama, reuniendo varias características que lo hacen apropiado para estas mujeres: alta eficacia, ausencia de hormonas involucradas en su efecto anticonceptivo, posibilidad de larga duarción y reversibilidad del mismo. A pesar de esas ventajas suele ser subutilizado. Remarcamos que también podría utilizarse con absoluta tranquilidad en mujeres nulíparas o nuligestas, si éste fuera el caso de nuestra paciente.
f. Métodos quirúrgicos
Son otro de los métodos de elección en mujeres con CM, difiriendo entre otras cosas con el DIU en cuanto a que los métodos quirúrgicos se consideran irreversibles. Es no hormonal, y altamente efectivo con un ídice de Pearl de 0,5.29 Lamentablemente considero baja la difusión en nuestro país, a pesar de que la Ley 26.130, la ley de esterilización quirúrgica, la legaliza para pesonas capaces y mayores de edad y posibilita su cobertura en el ámbito público y privado desde el año 2006. Es requerimiento previo al procedimiento el consentimiento informado (propio). La ligadura tubaria puede ser laparoscópica o laparotómica, utilizando diferentes técnicas: oclusión, corte y coagulación (salpingectomía parcial), Filshie clips, anillos de silastic, u oclusión transcervical (Essure®). 30 En los EEUU aproximadamente un 38% de mujeres usan la ligadura tubaria como métodos contraceptivo. Otro método quirúrgico es la vasectomía o ligadura de conductos deferentes. Igualmente avalado por ley, como agentes de salud podemos tomar un rol de difundir este método, desmistificando y estimulando su uso.
En este apartado veo importante mencionar una nueva perspectiva asociada a la ligadura tubaria: la importante reducción que genera en el cáncer de ovario. El punto es que en mujeres con cáncer de mama afectadas por una mutación del BRCA tenemos también asociado un aumento de riesgo de cáncer de ovario. En pacientes de alto riesgo con mutaciones del BRCA1 hay un riesgo de 40 a 60 % para desarrollo de cáncer de ovario y en mutaciones del BRCA2 es del 11 al 30 %. Es por ello que en ese grupo está recomendada con paridad cumplida la salpingooforectomía bilateral
En ese sentido la ligadura tubaria, además de anticoncepción, proveería con una herramienta de reducción de riesgo nada despreciable según las cifras con las que contamos. Las nuevas tendencias sugieren no sólo la ligadura, si no directamente la extirpación de toda la trompa para una mayor disminución del riesgo de cáncer de ovario. Este nuevo paradigma de reducción de riesgo se basa en nuevos estudios que hablan de evidencia sobre diferentes orígenes del cáncer de ovario. Se plantea que el subtipo histológico adenocarcinoma seroso tendría origen en la trompa distal. Intervendrían en su génesis sustancias carcinogénicas, proinflamatorias, infecciosas, que actuarían por vía ascendente desde el tracto genital inferior. Sería por impedir el ascenso de dichas sustancias que la ligadura tubaria disminuiría el riesgo de cáncer de ovario en un 24 al 34%. Pero si extirpáramos (y no solo ligáramos) la trompa, la salpingectomía podría bajar riesgo de cáncer de ovario hasta en un 49%.31, 32
Es por ello que se habla de la “Salpingectomía de la oportunidad”, es decir, en ocasión de una cirugía por anticoncepción, o por otro motivo, ej. Histerectomía por miomas, se plantea aprovechar esa oportunidad quirúrgica para extirpar también la trompa y poder reducir el riesgo de cáncer de ovario. Esto despierta mucho interés dada la ausencia de un screening válido para este tumor y la alta mortalidad que tiene el mismo. La salpingetomía de la oportunidad tiene aún una aplicación heterogénea, pero que va en aumento. Se recomienda el procedimiento como dijimos aún en cirugías no anticonceptivas, pero en las ligaduras por anticoncepción el sacar la trompa elimina la posibilidad de fallas anticonceptivas de ligadura, cobrando un además un rol protagónico en anticoncepción en pacientes con mutación conocida del gen BRCA. 33
g. SIU o sistema uterino liberador de levonorgestrel
Cuando hablamos de SIU hablamos de un excelente anticonceptivo de larga duración, que posee además beneficios no contraceptivos. Es un método hormonal, con un contenido total de 52 mg del progestágeno levonorgestrel (LNG), presentando una liberación inicial de 20 µgr, la cual va disminuyendo conforme pasa el tiempo. El tiempo de uso aprobado al momento es de 5 años.
Tiene como beneficio no contraceptivo la posibilidad de prevención de patología endometrial, y en la post menopausia, tal efecto sería ideal en pacientes tomando tamoxifeno. Han sido publicados trabajos al respecto. Sin embargo su uso al momento es controversial en estas pacientes con antecedente de cáncer de mama, dado que aún no hay seguridad sobre los efectos del LNG sistémico en cuanto a cómo ésto podría afectar con respecto a la recurrencia del cáncer de mama. Si bien el SIU tiene un efecto predominantemente uterino, se sabe que hay una pequeña proporción de la sustancia que circula a nivel sistémico, probablemente a un nivel mucho más bajo que cualquier método oral, implante o inyectable, pero cuyos efectos aún desconocemos con respecto a las células del cáncer de mama.24
Entonces cabe cuestionarnos ¿qué pasa con el SIU en pacientes con cáncer de mama? Surgen diferentes cuestiones. En principio hay discusión sobre si aumenta o no el cáncer de mama en la población general 34, 35 y por otro lado si afecta la recurrencia en mujeres con cáncer de mama previo. Por otro lado ¿es lo mismo una usuaria de SIU que desarrolla CM que una paciente con CM a la que se le coloca un SIU? ¿Afecta el progestágeno a la célula de cáncer de mama? ¿Son iguales todos los progestágenos en su acción sobre la mama? ¿La baja dosis de LNG circulante es suficiente para tener efecto negativo sobre la mama? ¿Qué pasaría en tumores con receptores hormonales negativos?
Lamentablemente son pocas las respuestas que pueden darse a estas cuestiones a la luz de la información de la que disponemos actualmente.
Con respecto al cuestionamiento sobre la dosis sistémica del LNG liberado por el SIU, es decir, si ésta es o no baja, es verdad que se alcanzan dosis menores a las correspondientes a un anticonceptivo oral combinado con LNG, pero hay que ser cautos.36 El SIU de 52 mg libera inicialmente una dosis de 20 mcrg/día, pudiendo llevar a concentraciones plasmáticas de 150–200 pg/mL de levonorgestrel en mujeres premenopáusicas que lo utilizan.37 Sin embargo reportes recientes describen dosis plasmáticas más altas en algunos subgrupos de usuarias. En mujeres premenopáusicas tratadas por endometriosis se habían alcanzado luego de 3 meses de SIU- LNG concentraciones séricas de 368.2 +- 51.8 pg/mL y de 357.3 +- 53.0 pg/mL luego de 6 meses.36 En una población de mujeres postmenopáusicas se observaron concentraciones medias de LNG de 209 pg/mL y 212 pg/mL luego de 6 y 12 meses, respectivamente. Estas concentraciones son comparables a las alcanzadas con una minipíldora oral de 30 microgramos de LNG, en cuyo estado estacionario en plasma el LNG alcanza valores de 312 +- 211.9 pg/mL.38, 39
Estos estudios muestran una gran diferencia entre mujeres sobre la captación sistémica del LNG del SIU, ya que en ciertos subgrupos esta capatación podría ser idéntica a la producida por una administración por vía oral, de allí la necesidad de precaución al hablar indiscutiblemente de baja dosis.
Sin embargo recordemos que según un metaanálisis, los progestágenos no aumentarían el riesgo de cáncer de mama en la población general, con estudios no demasiado grandes, pero no disponemos a su vez de información sobre el riesgo puntual en mujeres con cáncer de mama.
En 2008 se publica un trabajo belga, que involucró 6 centros.36 El mismo fue retrospectivo y de análisis de cohorte. El objetivo fue evaluar la tasa de recurrencia de CM en pacientes que usaban SIU LNG. Se estudiaron 79 usuarias con cáncer de mama invasor y SIU y 120 controles con cáncer de mama invasor, ambos grupos con coincidencias en edad al diagnóstico, estadío y grado tumoral y tratamientos recibidos, con una media de 40 años de edad. Se excluyeron aquellas que se retiraron el SIU. El grupo de usuarias de SIU con CM se subdividió a posteriori en dos:
- Subgrupo SIU y CM posterior (38 mujeres, teniendo un SIU colocado desarrollan CM)
- Subgrupo CM y posteriormente SIU (41 mujeres, tienen un CM y con posterioridad al diagnóstico se colocan un SIU, ya sea por anticoncepción, por patología endometrial o por sangrado mentrual abundante).
En este estudio, si bien con un número pequeño de mujeres, no encontraron asociación estadísticamente significativa entre SIU y mayor tasa de recurrencia. La tasa de recurrencia fue de 21% en el grupo con SIU (17 de 79) y de 16,6% en no usuarias de SIU (20 de 120). El Hazard Ratio (HR) ajustado fue de 1.86 (95% IC, 0.86–4.00), sin observarse diferencias significativas.
Luego del análisis inicial los autores dividen a las usuarias de SIU en los subgrupos mencionados y observan lo siguiente: si bien tomando SIU vs no SIU, NO observan diferencias significativas, en el subgrupo de mujeres que durante el uso de SIU desarrollan CM (38), SÍ observaron un aumento estadísticamente significativo borderline del riesgo (HR 3.39, 95% IC, 1.01–11.35). En este subgrupo, hubo un 47,4% (18/38) de positividad ganglionar y todas las pacientes que recurrieron tuvieron metástasis. No reportan diferencia de positividad de receptores hormonales en ambos subgrupos. Una hipótesis es que un tumor que se desarrolla durante una exposición hormonal, como en este caso al LNG, podría ser más agresivo.
Como limitaciones de este trabajo citamos el grupo pequeño de pacientes implicadas, el hecho de que el subanálisis en grupos surge a posteriori y la posibilidad de que haya un sesgo de prescripción de SIU en pacientes con alto riesgo previo de cáncer de mama, dado que en ese tipo de mujeres los profesionales muchas veces escapan a prescribir métodos hormonales combinados u orales. Con los cual se necesitan estudios adicionales, así como cautela en interpretación de los resultados obtenidos.
Se necesita mayor investigación, sobre todo prospectiva, dado el impacto en la práctica diaria. Necesita definirse qué hacemos con el SIU de una paciente con diagnóstico de CM. Si se replica el riesgo en otros estudios, y eso es lo que sucede en la práctica clínica actualmente, desde ya que tenemos que buscar otras opciones anticonceptivas. Según este estudio de Trinh 36, aunque con bajo número de pacientes, si se tratara de una paciente ya tratada por CM podría considerarse colocar un SIU sin aumentar recurrencia. Los autores, de todos modos, recomiendan evitarlo en premenopaúsicas con castración médica y recibiendo inhibidores de la aromatasa, por existir en este grupo una hipersensibilidad a hormonas.
h. Utilidad posible del SIU para evitar cambios inducidos por tamoxifeno (no aún Ca. de endometrio)
Se sabe que existe utilidad posible del SIU para evitar cambios endometriales inducidos por tamoxifeno (TMX) , si bien no aún no se ha podido demostrar la disminución de casos de cáncer de endometrio asociados a TMX.
En una revisión de Cochrane, cuyo objetivo primario fue determinar eficacia y seguridad del SIU en pre y post menopáusicas tomando TMX con respecto a patología endometrial y uterina (evaluada por histeroscopía y biopsia), evaluaron como objetivos secundarios aquellos eventos relacionados al cáncer de mama.40
Se buscaron estudios randomizados y controlados (RCT) en mujeres con CM en tratamiento con TMX comparando la incidencia de patología endometrial entre solamente el seguimiento versus la utilización de SIU-LNG más seguimiento.
Se seleccionaron 4 RCT (Chan 2007, Gardner 2000, Kesim 2008, Omar 2010)41-46 incluyendo 453 mujeres pre y post menopáusicas (273 en grupo TMX+SIU y 270 TMX). En el grupo con SIU se observó una reducción en la aparición de pólipos a 12, 24 y 60 meses con un Odds Ratio (OR) de 0,22; tambipen reducción en la hiperplasia de endometrio (a 24 y 60 meses un OR 0,13). En cuanto a reducción en Carcinoma de Endometrio los estudios no llegaron a un poder estadístico suficiente para demostrar su reducción. Dado el mecanismo de acción del SIU, en el grupo de usuarias se observó al principio más sangrado anormal y spotting con disminución en el tiempo.
El objetivo secundario del estudio es en lo que focalizamos nosotros: ¿qué sucede con las recurrencias en las mujeres con SIU? En este análisis de Cochrane las recurrencias fueron evaluados en sólo 2 (N: 154) de los 4 RCT analizados. Las recurrencias de CM fueron 16, y las muertes por CM fueron 18, sin diferencias con el grupo control. Las recurrencias de mujeres con SIU y TMX fueron del 14,3% vs 9,1% en grupo control de sólo TMX (OR 1,74). Las muertes fueron evaluadas en 3 de los 4 RCT analizados, con un OR 1,02 (5,8 vs 5,7% en cada grupo, con un n de 137 y 140 en cada grupo). Sin embargo la calidad de la evidencia es moderada según el número muestral y la baja tasa de eventos.
Luego es interesante comentar otro metaanálisis de los chinos Yun fu y Z. Zhuang, 47 con respecto al uso del SIU-LNG y sus efectos a largo plazo en usuarias de tamoxifeno. Analizan 3 RCT (Gardner 2009, Kesim 2008, Wong 2013) 44, 45, 48: el endpoint a analizar fue evaluar la eficacia del SIU para prevenir patología endometrial asociada a TMX. Suman entre estos estudios 359 pacientes. De ellas, 175 se encontraban en el grupo de TMX + SIU y 184 en el grupo control (sólo recibían TMX). Este metaanálisis no observa un aumento de incidencia de recurrencia de CM y muerte relacionada a CM. La recurrencia observada en el grupo TMX+SIU fue de 6.3% (n=11) y en el control fue de 3.8% (n=7). Si bien como se observa son más las recurrencias en el grupo con SIU y TMX, este valor no arroja una diferencia estadísticamente significativa (P = 0.28, OR 1.75). En cuanto a muertes, fueron 4.6% (8) en TMX+SIU y 3.8% (7) en el grupo control, sin diferencia significativa en este tópico tampoco (P = 0.71, OR 1.22). A pesar de estos resultados promisorios en cuanto a protección de patología endometrial, se necesitan estudios randomizados a largo plazo sobre SIU-LNG en mujeres con CM para determinar certeramente los riesgos y beneficios en el tratamiento con TMX. El promedio de edad del grupo de tratamiento fue de 51 años, siendo postmenopáusicas el 80% de las mujeres incluidas.
El tema anticoncepción creemos no queda afuera de este cuestionamiento. Es decir, si bien las mujeres con CM necesitan una anticoncepción altamente efectiva, y el SIU definitivamente cumple con ese requisito, los beneficios que brinda a nivel anticonceptivo y no anticonceptivo (como regulación del sangrado y protección endometrial) deben sopesarse con la falta de evidencia que descarte la acción del LNG circulante que puede provenir del SIU en cuanto a afectar una posible recurrencia del CM. Es por ello que hoy por hoy el uso del SIU no está aceptado en este grupo de pacientes, si bien en algún caso particular, bajo la supervisión médica y con la decisión informada de la paciente y el oncólogo se podría llegar a utilizar en forma excepcional.
i. Anticoncepción de emergencia
El último y pequeño apartado de este artículo tiene la idea de refrescar un concepto importante: no existen contraindicaciones absolutas para la anticoncepción de emergencia. El antecedente de cáncer de mama no es la excepción: puede utilizarse sin problemas si resultara necesaria. Si bien el cáncer de mama se considera hormonodependiente, en anticoncepción de emergencia los beneficios sobrepasan a los riesgos.49 El más utilizado y disponible en nuestro medio es el Levonorgestrel (LNG). De todas maneras vale la pena recordar que el DIU de cobre es el método más efectivo de anticoncepción de emergencia y puede utilizarse hasta 5 días post coito sin perder eficacia, con una tasa de falla de sólo 0.14. En el uso de DIU como anticoncepción de emergencia el efecto prominente es pre fertilización. En pacientes con CM, puede ser útil ya que si se coloca DIU “de emergencia” luego se puede dar continuidad al método, ya que como hemos visto, es uno de los principales métodos recomendados en CM. El acetato de ulipristal como anticoncepción de emergencia se utiliza en la dosis de 30 mg y es categoría 2 en cáncer de mama, o sea, puede utilizarse sin problema, así como también la mifepristona. Ninguna de esas dos drogas están disponibles en nuestro país para uso en anticoncepción de emergencia.
j. Nuevas preguntas e inquietudes
Recientemente se han retomado investigaciones sobre un estrógeno llamado estetrol (E4). El mismo es un estrógeno natural, producido por el hígado fetal. Se conoce hace mucho pero el renovado interés en él surge dado que tiene un mínimo impacto hepático, lo cual permite su potencial uso en anticoncepción y terapia hormonal menopáusica, donde siempre se buscan compuestos con menores efectos adversos. Se ha visto que el estetrol es cien veces menos potente que el Estradiol (E2) para estimular células mamarias humanas in vitro y murinas in vivo.50
Presenta baja afinidad por el receptor estrogénico (RE) y en presencia de E2 actúa como antagonista. Esto podría darnos a futuro un elemento más de “protección mamaria” asociado a la anticoncepción.
Otro interrogante, dado que no hay bibliografía al respecto, es qué sucede con el SIU-LNG 13,5 (Blusiri® en nuestro país). Este SIU tiene una menor carga hormonal que el conocido SIU 52 mg (Mirena® en nestro país).51 Si bien no se sabe a ciencia cierta como dijimos qué sucede con el LNG del SIU de 52 mg en una mujer con cáncer de mama, tampoco sabemos qué pasa con el dispositivo que tiene un tercio de LNG. Lo que sí sabemos de este último es que dada su menor dosis hormonal total tiene menor liberación diaria de LNG. Si bien a nivel anticonceptivo esto no disminuye significativamente su eficacia, tal vez, desde el punto de vista teórico, menos tasa de liberación implique menor efecto sistémico y potencialmente menor efecto mamario. Pero ¿mantendrá este dispositivo los efectos postivos endometriales en mujeres con tamoxifeno?
3. Conclusión
En una mujer joven y fértil que tiene o ha tenido cáncer de mama tenemos una mujer con necesidades especiales en cuanto a su salud sexual y reproductiva. Entonces podemos concluir
¿Qué SÍ se puede hacer en cuanto a anticoncepción en una mujer con cáncer de mama?
- Es bueno acompañar e indagar sobre el uso correcto de métodos anticonceptivos
- Asegurarle la provisión de un MAC para evitar un embarazo no planificado. Esa situación puede ser devastadora frente a un diagnóstico reciente de cáncer de mama, más allá de que sabemos que hay más abortos y malformaciones asociadas al tratamiento del CM
- Debemos ofrecer métodos no hormonales, preferiblemente el DIU de Cobre (por su alta eficacia, categoría 1 OMS)
- Podemos ofrecer métodos quirúrgicos si existe preferencia por métodos irreversibles, por su alta eficacia y ausencia de hormonas
- Sería importante detectar casos que se beneficiarían con la salpingectomía de reducción de riesgo o salpingooforectomía, como aquellas mujeres con una mutación conocida del gen BRCA.
- En lo posible informar sobre la posibilidad de uso sin contraindicaciones a pesar del cáncer de mama de la anticoncepción de emergencia
Que NO se puede hacer en cuanto a anticoncepción en una mujer con cáncer de mama?
- Si contraindicamos el embarazo por un motivo oncológico no podemos no preguntar si la mujer está usando un método anticonceptivo efectivo. Es muy interesante poder trabajar en un equipo multidisciplinario para abordar esta temática, ya que como médicos oncólogos o mastólogos, el tiempo en la consulta es acotado para poder abordar temas de anticoncepción, o bien no se tiene el manejo de los diferentes métodos anticonceptivos, a nivel práctico o teórico
- No se recomienda suspender el MAC que está usando la paciente abruptamente post diagnóstico de CM, al menos esperar hasta que nos aseguremos que le hemos indicado y está utilizando otro método efectivo
- Recordemos no prohibir el uso de la anticoncepción de emergencia por el antecedente de CM
- No se recomienda el uso de métodos hormonales por ninguna de las vía de administración disponibles (vías orales, inyectables, parches, anillos). El mismo concepto de contraindicación aplica para métodos de sólo progestágenos (como SIU con LNG o implante)
- Si bien el SIU previene efectivamente patología endometrial asociada al TMX y tiene baja dosis de LNG sistémica aún no hay evidencia de que no afecte la recurrencia de la enfermedad, con lo cual su uso no está recomendando
- Si de forma excepcional se llegara a utilizar el SIU en CM en algún caso particular, esto debe ser bajo supervisión médica, con autorización del oncólogo y con la decisión informada de la paciente, recomendándose un consentimiento informado por escrito, dada la falta de infromación científica al respecto
Bibliografía
-
Hamy AS, Abuellellah H, Hocini H, et al. Contraception after breast cancer: a retrospective review of the practice among French gynecologists in the 2000's. Eur J Gynaecol Oncol. 2014;35(2):149-53
-
Güth U, Huang DJ, Bitzer J, et al. Contraception counseling for young breast cancer patients: A practical needs assessment and a survey among medical oncologists. Breast. 2016 Dec;30:217-221
-
Dominick SA, McLean MR, Whitcomb BW, et al. Contraceptive practices among female cancer survivors of reproductive age. Obstet Gynecol. 2015;126:498–507.
-
Partridge AH, Gelber S, Peppercorn J, et al. Fertility and menopausal outcomes in young breast cancer survivors. Clin Breast Cancer 2008; 8:65–9
-
Vandenbroucke T, Verheecke M, Van Calsteren K, et al. Fetal outcome after prenatal exposure to chemotherapy and mechanisms of teratogenicity compared to alcohol and smoking. Expert Opin Drug Saf. 2014;13:1653–1665
-
Sarno MA, Mancari R, Azim HA Jr, Colombo N, Peccatori FA. Are monoclonal antibodies a safe treatment for cancer during pregnancy? Immunotherapy 2013 Oct; 5(10):1146.
-
Kathryn J Ruddy, MD, MPH, Ann H Partridge, MD, MPH. Approach to the patient following treatment for breast cancer. www.uptodate.com
-
Güth U, Huang DJ, Bitzer et al. Unintended pregnancy during the first year after breast cancer diagnosis. The European Journal of Contraception & Eur J Contracept Reprod Health Care 2016; 21(4):290-4
-
Busief ME, Missmer SA, Ginsburg ES, et al. The effects of paclitaxel, dose density, and trastuzumab on treatment-related amenorrhea in premenopausal women with breast cancer. Cancer 2010;116:791–798
-
Hamy AS et al. Contraception after breast cancer: a retrospective review of the practice among French gynecologists in the 2000's. Eur J Gynaecol Oncol. 2014;35(2):149-53.
-
Criterios de elegibilidad de la OMS http://www.who.int/reproductivehealth/es
-
Patel A, Schwarz EB. Society of Family Planning. Guideline #20121. Cancer and contraception. Contraception 2012. 86: 191-8.
-
USMEC https://www.cdc.gov/reproductivehealth/contraception/usmec.htm
-
UKMEC https://www.fsrh.org/documents/ukmec-2016/final-book-july-2017.pdf
-
Liang Y, Benakanakere I, Besch-Williford C, Hyder RS, Ellersieck MR, Hyder SM. Synthetic progestins induce growth and metastasis of BT-474 human breast cancer xenografts in nude mice. Menopause 2010; 17: 1040–7.
-
Lanari C, Molinolo AA. Progesterone receptors — animal models and cell signalling in breast cancer. Diverse activation pathways for the progesterone receptor: possible implications for breast biology and cancer. Breast Cancer Res 2002; 4: 240–3.
-
Kotsopoulos J et al.Timing of oral contraceptive use and the risk of breast cancer in BRCA1 mutation carriers. Breast Cancer Res Treat. 2014; 143 (3):579-86
-
Friebel TM. Modifiers of cancer risk in BRCA1 and BRCA2 mutation carriers: systematic review and meta-analysis. J Natl Cancer Inst. 2014 Jun; 106(6)
-
Gadducci A, Biglia N, Cosio S, Sismondi P, Genazzani AR. Gynaecologic challenging issues in the management of BRCA mutation carriers: oral contraceptives, prophylactic salpingo-oophorectomy and hormone replacement therapy. Gynecol Endocrinol. 2010; 26(8):568-77.
-
Samson M, Arp Adams S, Porter N, et al. Progestin and breast cancer risk: a systematic review. Breast Cancer Res Treat 2016; 155:3–12
-
Strom BL, Berlin JA, Weber AL, Norman SA, Bernstein L, Burkman RT et al. Absence of an effect of injectable and implantable progestin-only contraceptives on subsequent risk of breast cancer. Contraception 2004. 69(5):353–360
-
Fabre A, Fournier A, Mesrine S, Desreux J, Gompel A, Boutron Ruault M-C et al. Oral progestagens before menopause and breast cancer risk. Br J Cancer (2007). 96(5):841–844
-
Yang Z, Hu Y, Zhang J, Xu L, Zeng R, Kang D. Estradiol therapy and breast cancer risk in perimenopausal and postmenopausal women: a systematic review and meta-analysis. Gynecol Endocrinol. 2017 Feb;33(2):87-92.
-
McNaught J, Reid RL; SOGC/GOC Progesterone-only and non-hormonal contraception in the breast cancer survivor: Joint Review and Committee Opinion of the Society of Obstetricians and Gynaecologists of Canada and the Society of Gynecologic Oncologists of Canada., J Obstet Gynaecol Can. 2006 Jul;28(7):616-39.
-
Ruan X. Progestogens and membrane-initiated effects on the proliferation of human breast cancer cells. Climacteric 2012;15: 467–472
-
Lee NC, Rosero-Bixby L, Oberle MW, Grimaldo C, Whatley AS, Rovira EZ. A case-control study of breast cancer and hormonal contraception in Costa Rica. JNCI 1987;79 (6):1247–54.
-
Paul C, Skegg DC, Spears GF. Depot medroxyprogesterone (Depo-Provera) and risk of breast cancer. Br Med J 1989; 299:759–62.
-
Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Lancet 1996;347:1713–27
-
Trussell J. Contraceptive failure in the United States. Contraception 2004;70:89–96
-
De Batista Depes D, Gomes Pereira AM, Alfredo Martins JA, Gazi Lippi U, Guedes Coelho Lopes R. Initial experience with hysteroscopic tubal occlusion (Essure®). Einstein 2016; 14(2):130-4.
-
Yoon SH et al. Bilateral salpingectomy can reduce the risk of ovarian cancer in the general population: A meta-analysis. Eur J Cancer 2016 ;55:38-46.
-
Callahan RL, Kopf GS, Strauss JF, Tworoger SS. Tubal contraception and ovarian cancer risk: a global view. Contraception 2017; 95(3):223-226.
-
Westberg J, Scott , Creinin MD. Safety outcomes of female sterilization by salpingectomy and tubal occlusion. Contraception 2017; 95(5):505-508
-
Backman T, Rauramo I, Jaakkola K, Inki P, Vaahtera K, Launonen A, Koskenvuo M. Use of the levonorgestrel-releasing intrauterine system and breast cancer. Obstet Gynecol 2005; 106: 813-817.
-
Siegelmann-Danieli N, Katzir I, Landes JV, et al. Does levonorgestrel-releasing intrauterine system increase breast cancer risk in peri-menopausal women? An HMO perspective. Breast Cancer Res Treat. 2017 Sep 14. 2017 Sep 14. doi: 10.1007/s10549-017-4491-2. [Epub ahead of print]
-
Trinh Xuan Bich, Buytaert G, Tjalma WAA, Weyler J, Makar AP, van Dam PA Use of the levonorgestrel-releasing intrauterine system in breast cancer patients. Fertil Steril 2008; 90:17–22.
-
Sturridge F, Guillebaud J. A risk-benefit assessment of the levonorgestrel-releasing intrauterine system. Drug Saf. 1996 Dec;15(6):430-40
-
Haimov-Kochman R, Amsalem H, Adoni A, Lavy Y, Spitz IM. Management of a perforated levonorgestrel-medicated intrauterine device— a pharmacokinetic study: case report. Hum Reprod 2003; 18:1231–3.
-
Pakarinen P, Lahteenmaki P, Rutanen EM. The effect of intrauterine and oral levonorgestrel administration on serum concentrations of sex hormone-binding globulin, insulin and insulin-like growth factor binding protein-1. Acta Obstet Gynecol Scand 1999; 78:423–8.
-
Dominick S, Hickey M, Chin J, Su HI. Levonorgestrel intrauterine system for endometrial protection in women with breast cancer on adjuvant tamoxifen. Cochrane Database of Systematic Reviews 2015, Issue 12. Art. No.: CD007245.
-
Chan SSC, Tam WH, Yeo W, Yu MMY, Ng DPS, Wong AWY, et al. A randomised controlled trial of prophylactic levonorgestrel intrauterine system in tamoxifen treated women. BJOG 2007;114 (12):1510-
-
Wong AWY, Chan SSC, Yeo W, Yu MY, Tam WH. Prophylactic use of levonorgestrel-releasing intrauterine system in women with breast cancer treated with tamoxifen: a randomized controlled trial. Obstetrics and Gynecology 2013; 121(5):943–50.
-
Gardner FJE, Konje JC, Abrams KR, Brown LJR, Khanna S, Al-Azzawi F, et al. Endometrial protection fromtamoxifen-stimulated changes by a levonorgestrel-releasing intrauterine system: a randomised controlled trial. Lancet 2000; 356(9243):1711–7.
-
Gardner FJE, Konje JC, Bell SC, Abrams KR, Brown LJ, Taylor DJ, Habiba M. Prevention of tamoxifen induced endometrial polyps using levonorgestrel releasing intrauterine system: Long-term follow-up of a randomized control trial. Gynecologic Oncology 2009; 114(3):452–6.
-
Kesim MD, Aydin Y, Atis A, Mandiraci G. Long-term effects of the levonorgestrel-releasing intrauterine system on serum lipids and the endometrium in breast cancer patients taking tamoxifen. Climacteric 2008; 11(3):252–7.
-
Omar H, Elkhayat W, Aboulkasem M. The use of levonorgestrel-releasing intrauterine system in prevention of endometrial pathology in women with breast cancer treated with tamoxifen. The International Journal of Medicine 2010; 3(1):327–330.
-
Yun Fu, Zhigang Zhuang. Long-term effects of levonorgestrel-releasing intrauterine system on tamoxifen-treated breast cancer patients: a meta-analysis. Int J Clin Exp Pathol 2014; 7(10): 6419-6429
-
Wong AW, Chan SS, Yeo W, Yu MY, Tam WH. Prophylactic use of levonorgestrel-releasing intrauterine system in women with breast cancer treated with tamoxifen: a randomized controlled trial. Obstet Gynecol 2013; 121: 943-950.
-
Koyama A, Hagopian L, Linden J. Emerging Options for Emergency Contraception.Clin Med Insights Reprod Health. 2013; 7: 23–35.
- Gerard. C. Estetrol is a weak estrogen antagonizing estradiol-dependent mammary gland proliferation. Journal of Endocrinology 2015; 224, 85–95
- Gemzell-Danielsson K, Buhling KJ, Dermoutet SM et al. A Phase III, single-arm study of LNG-IUS 8, a low-dose levonorgestrel intrauterine contraceptive system (total content 13.5 mg) in postmenarcheal adolescents. Contraception 2016; 93: 507–512



