Evaluación de la microbiota vaginal en usuarias de diferentes métodos anticonceptivos
 Autores: Ledinic A1, Reyes A2,3, Gómez Cherey J1, Payalef S23, Puñal A1, Losada M2,3, Salamanca C1, Blanco A1, Vay C2,3, Maldonado V1, Famiglietti A2,3, , Fleider L1, Ortiz J4, Perazzi B2,3
Autores: Ledinic A1, Reyes A2,3, Gómez Cherey J1, Payalef S23, Puñal A1, Losada M2,3, Salamanca C1, Blanco A1, Vay C2,3, Maldonado V1, Famiglietti A2,3, , Fleider L1, Ortiz J4, Perazzi B2,3
1 Universidad de Buenos Aires. Hospital de Clínicas "José de San Martín". División Ginecología. Sección Tracto Genital Inferior. CABA, Argentina.
2 Universidad de Buenos Aires, Facultad de Farmacia y Bioquímica, Hospital de Clínicas "José de San Martín", Departamento de Bioquímica Clínica, Laboratorio de Bacteriología Clínica. CABA, Argentina.
3 Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Instituto de Fisiopatología y Bioquímica Clínica (INFIBIOC). CABA, Argentina.
4 Universidad de Buenos Aires. Hospital de Clínicas "José de San Martín". Jefe División Ginecología. CABA, Argentina.
Mail de contacto: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Resumen
Objetivos: Evaluar el desbalance de la microbiota vaginal, prevalencia de vaginosis bacteriana (VB), levaduras, trichomoniasis y reacción inflamatoria vaginal (RIV) en usuarias de distintos métodos anticonceptivos (MAC).
Métodos: Estudio consecutivo, prospectivo y transversal. Se examinaron pacientes de 18-50 años. Se realizó examen clínico, estudio de BACOVA y cultivo. Se utilizó test de χ2 y Fisher. Se consideró significativo p< 0,05.
Resultados: Se analizaron 1303 pacientes divididas en: Grupo 1 (G1) anticonceptivos orales combinados (ACO) (n=314), Grupo 2 (G2) Preservativo (n=385), Grupo 3 (G3) DIU-Cu (n=92), Grupo 4 (G4) Ligadura tubaria (n=26), Grupo 5 (G5) Control (n=486). La prevalencia de VB de desbalance fue: G1 34,4% (p=0,18), G2 42,1% (p=0,12), G3 48,9% (p=0,05), G4 53,8% (p=0,14), G5 37,9%. Los grupos con mayor prevalencia de VB fueron G3 41,3% (p=0.03) y G4 50% (p=0,05). Los grupos con mayor prevalencia de levaduras fueron G3 31,5% (p=0,01) y G4 38,5% (p=0, 02). El 82,8% (p=0,01) del G3 con levaduras presentó estados inflamatorios. G3 presentó mayor prevalencia de RIV (58,7%-p=0,01).
Conclusiones: Se observó mayor desbalance de microbiota, prevalencia de VB y levaduras en usuarias de DIU-Cu. En usuarias de ACO predominó el balance de la microbiota. Las usuarias de DIU-Cu presentaron mayor RIV, por ser un cuerpo extraño.
Palabras Clave: Microbiota, Vaginosis bacteriana, Levaduras, reacción inflamatoria vaginal, Trichomoniasis, Anticonceptivos orales combinados, Preservativo, Dispositivo intrauterino, Ligadura Tubaria.
Abstract
Objectives: To evaluate vaginal unbalance, prevalence of bacterial vaginosis (BV), yeasts, trichomoniasis and vaginal inflammatory reaction (VIR) in patients using different contraceptive methods.
Methods: Consecutive, prospective, cross-sectional study. Patients aged 18-50 years, were assessed by clinical examination, BAVACO study and culture. Chi-square test (χ2) and Fisher's test were used. p<0.05 was considered significant.
Results: 1303 patients were divided into: Group 1 (G1) oral contraception pill (OCP) (n=314), Group 2 (G2) Condom (n=385), Group 3 (G3) IUD-cu (n=92), Group 4 (G4) tubal ligation (n=26), Group 5 (G5) Control (n=486). The prevalence of vaginal unbalance was: G1 34.4% (p=0.18), G2 42.1% (OR 1.19 p=0.12), G3 48.9% (p=0.05), G4 53.8% (p=0.14), G5 37.9%. The groups that had higher BV prevalence were G3 41.3% (p=0.03) and G4 50% (p=0.05). The groups with the highest yeasts prevalence were G3 31.5% (p=0.01) and G4 38.5% (p=0.02). The 82.8% (p=0.01) of G3 with yeasts presented inflammatory states. G3 had a higher prevalence of VIR of 58.7% (p=0.01).
Conclusions: A greater vaginal unbalance, prevalence of BV and yeasts was observed in IUD-Cu users. The microbiota balance was predominant in OCP users. IUD-Cu users presented higher VIR because it was a foreign body.
Keywords: Microbiota, Bacterial Vaginosis, Vaginal Yeasts, Vaginal inflammatory reaction, Trichomoniasis, Oral Contraceptives Combined, Condoms, Intrauterine Devices, Tubal Ligations.
Introducción
La microbiota vaginal es un complejo sistema de microorganismos relacionados y en permanente equilibrio que varía a lo largo de la vida. En la pubertad, por
estímulo estrogénico, aumenta el predominio de lactobacilos.1 De esta forma, bajo su acción, el epitelio estratificado aumenta su espesor y los lactobacilos producen ácido láctico como metabolito final de la glucosa.2
El ecosistema vaginal puede ser desequilibrado por una amplia variedad de factores, algunos endógenos y otros exógenos (como la anticoncepción o la terapia de reemplazo hormonal).3
En la población argentina, acorde a la Encuesta Nacional sobre Salud Sexual y Reproductiva (ENSSyR), los métodos más utilizados son los hormonales (50,5%) y el preservativo (29,6%). Sin embargo, en el Área Metropolitana de Buenos Aires (AMBA) el 40,2 % de las pacientes utilizan métodos hormonales y el 40% preservativo.4
El uso de anticonceptivos orales combinados (ACO) se ha asociado con aumento en la abundancia relativa de lactobacilos.5 Respecto a los demás métodos anticonceptivos (MAC) (preservativo, dispositivos intrauterinos de cobre-DIU-Cu, ligadura tubaria-LT) la evidencia es discordante y limitada.
Objetivos
- Evaluar el desbalance de la microbiota vaginal mediante los Estados Vaginales Básicos (EVB) por metodología del Balance del Contenido Vaginal (BACOVA) en usuarias de MAC (preservativos, ACO, DIU-Cu, LT) respecto de pacientes no usuarias de MAC (control).
- Evaluar la presencia de vaginosis bacteriana (VB), levaduras y trichomoniasis en usuarias de MAC respecto del control.
- Evaluar la presencia de reacción inflamatoria vaginal (RIV) en usuarias de MAC respecto del control.
Materiales y Métodos
Estudio observacional, analítico, consecutivo, prospectivo, de corte transversal. Se examinaron 1326 pacientes entre enero 2013 a junio 2023. Este trabajo fue aprobado por el Comité de Ética del Hospital y todas las pacientes dieron su consentimiento informado.
Población y muestra
Criterios de inclusión
- Pacientes entre 18-50 años que hayan iniciado relaciones sexuales.
- Usuarias de MAC (Grupo de estudio: preservativos, ACO, anticonceptivos orales de progesterona, DIU-Cu, LT, anticoncepción inyectable (ACI), Sistema Intrauterino de Levonorgestrel (SIU-LNG), Implante Hormonal, Coitus interruptus y Anillo Vaginal).
- No usuarias de MAC: Control
Criterios de exclusión
- Uso de antibióticos 15 días previos a la consulta, corticoides o quimioterapia
- Pacientes embarazadas
- Pacientes sin inicio de relaciones sexuales
- Pacientes que no tuvieron abstinencia sexual 48 hs previas al examen
Criterios de eliminación
- Grupo de estudio cuyo número muestral sea menor a 10
Equipos, técnica e instrumentos
Luego de la firma del consentimiento informado se procedió a la recolección de datos para completar la ficha ginecológica. Además, se recogieron datos médicos y epidemiológicos de interés. A todas las pacientes se les realizó examen clínico y toma de fondo de saco vaginal para el estudio microbiológico por metodología convencional y estudio de los EVB mediante BACOVA.
El estudio microbiológico del contenido vaginal incluyó los siguientes exámenes:
- Extendidos para coloración de Gram y May-Grunwald Giemsa prolongado.
- Observación en fresco con 1 ml de solución fisiológica (SF).
- Observación en fresco con 1 ml de hidróxido de potasio (KOH) al 10%.
- Cultivo en medio líquido (tioglicolato modificado) para Trichomonas vaginalis, con incubación de 7 días a 37oC en atmósfera de 5% de dióxido de carbono.6
- Cultivo en agar base Columbia con 5% de sangre humana con incubación de 48 hs. a 37°C en atmósfera de 5% de dióxido de carbono, conservando la muestra en medio de Stuart.
La detección de levaduras se realizó a través de la observación en fresco con SF y con KOH al 10% y por cultivo en agar Sabouraud y agar sangre.
La investigación de T. vaginalis se realizó a través de la observación microscópica directa con SF, la coloración de May-Grunwald Giemsa prolongado y el cultivo en tioglicolato modificado.6, 7
El diagnóstico de VB se realizó utilizando el criterio de Nugent.8
El estudio del BACOVA, incluyó el análisis morfológico del contenido vaginal en función de la relación del valor numérico (VN) y RIV, identificándose 5 EVB: microbiota normal (I), microbiota normal más reacción inflamatoria (II), microbiota intermedia (III), VB (IV) y vaginitis microbiana inespecífica (V). 9
Procesamiento y análisis de datos
Para comparar las prevalencias de EVB, VB, levaduras y trichomonas en los distintos grupos de MAC respecto del control, se utilizó χ2 y test de Fisher. Se consideró significativo un valor de p <0,05. El análisis estadístico se realizó con Epi Data® versión 7.2.2.6.
Resultados
De las 1326 pacientes se excluyeron 23 por el bajo número muestral: anticoncepción inyectable (n=7), SIU-LNG (n=5), anticonceptivos orales de progesterona (n=3), implante hormonal (n=6), coitus interruptus (n=1) y anillo vaginal (n=1). Se analizaron 1303 pacientes divididas en 4 grupos: Grupo 1, ACO (n=314), Grupo 2 Preservativo (n=385), Grupo 3 DIU-Cu (n=92), Grupo 4 LT (n=26), Grupo 5 Control (n=486).
En la Tabla 1 se observan los MAC utilizados en nuestra población. Lo más frecuente fue la no utilización de MAC 36,6% (486/1326) seguido de preservativo 29,1% (385/1326) y ACO 23,7% (314/1326).
La prevalencia de EVB de desbalance vaginal (III, IV y V) fue: En el Grupo 1: 34,4% (OR: 0,86 IC95% 0,64-1,16 p=0,18), Grupo 2: 42,1% (OR 1,19 IC95% 0,91-15,57 p=0,12), Grupo 3: 48,9% (OR 1,57 IC95% 1,00-2,46 p=0,05), Grupo 4: 53,8% (OR 1,91 IC95% 0,87-4,22 p=0,14), Grupo 5: 37,9% (Tabla 2).
La prevalencia de VB en los distintos MAC respecto del control fue: Grupo 1: 29% (OR: 0,9 IC95% 0,66-1,23 p=0,52), Grupo 2: 37,4% (OR 1,32 IC95% 1,0-1,75 p=0,06), Grupo 3: 41,3% (OR 1,56 IC95% 0,98-2,46 p=0,03), Grupo 4: 50% (OR 2,21 IC95% 1,0-4,88 p=0,05), Grupo 5: 31,1%. El análisis de prevalencia de levaduras en los distintos MAC respecto del control fue: Grupo 1: 21,3% (OR: 1,11 IC95% 0,78-1,58 p=0,3), Grupo 2: 21,8% (OR 1,14 IC95% 0,82-1,6 p=0,23), Grupo 3: 31,5% (OR 1,89 IC95% 1,15-3,1 p=0,01), Grupo 4: 38,5% (OR 2,56 IC95% 1,13-5,83 p=0,02), Grupo 5: 19,6%. El análisis de prevalencia de trichomoniasis en los distintos MAC fue: Grupo 1: 3,5% (OR: 0,76 IC95% 0,36-1,6 p=0,3), Grupo 2: 4,4% (OR 0,97 IC95% 0,51-1,86 p=0,53), Grupo 3: 2,2% (OR 0,47 IC95% 0,11-2,02 p=0,23), Grupo 4: 7,7% (OR 1,75 IC95% 0,39-7,9 p=0,34), Grupo 5: 4,5%. (Tabla 3).
El análisis de prevalencia de RIV (Estados II/V) en los distintos grupos de MAC respecto del control fue el siguiente: Grupo 1: 44,9% (OR 0,98 IC95% 0,74-1,31 p=0,48), Grupo 2: 46,5% (OR 1,05 IC95% 0,87-1,37 p=0,38), Grupo 3: 58,7% (OR 1,71 IC95% 1,09-2,7 p=0,01), Grupo 4: 42,3% (OR 0,88 IC95% 0,4-1,97 p=0,46), Grupo 5: 45,4%. (Tabla 4).
En la Tabla 5 se observa la prevalencia de EBV con RIV (II/V) en pacientes con levaduras según el MAC respecto del control: Grupo 1: 64,2% (OR 1,41 IC95% 0,75-2,7 p=0,18), Grupo 2: 54,8% (OR 0,95 IC95% 0,53-1,73 p=0,5), Grupo 3: 82,8% (OR 3,8 IC95% 1,34-10,82 p=0,01), Grupo 4: 70% (OR 1,85 IC95% 0,45-7,59 p=0,3), Grupo 5: 55,8%.
Discusión
Según los resultados de nuestro estudio 36,6% de las pacientes no utilizaron ningún MAC. Según la ENSSyR, las mujeres informan que las principales razones de no usarlo son el embarazo actual o el deseo de quedar embarazada.4
En nuestra casuística el MAC más frecuente fue el preservativo (29,1%) seguido del ACO (23,7%). En la población argentina, los métodos más utilizados son los hormonales (50,5%) y el preservativo (29,6%). Sin embargo, en el AMBA el 40,2% de las pacientes utilizan métodos hormonales y el 40% preservativo.4
Acorde a nuestra investigación, en las usuarias de ACO predominó el balance de la microbiota (EVB I 36,3% y EVB II 29,3%). Estos resultados coinciden con otros estudios que hacen referencia a la relación estable entre el uso de ACO y una reducción en la prevalencia de la VB (EVB IV).3 Vodstrcil et al.10 demostraron un riesgo reducido de prevalencia, incidencia y recurrencia de VB en mujeres con ACO. Esto puede deberse a que el estrógeno induce la acumulación de glucógeno en el epitelio vaginal y el glucógeno influye en la colonización por lactobacilos, que confieren protección frente a estados de disbiosis (EVB IV y V).11
En nuestra casuística, la prevalencia de levaduras en usuarias de ACO fue 21,3%, distribuido un 64,2% en EVB con RIV (II-V) y un 35,8% en EVB sin RIV (I-III-IV). En concordancia con los resultados de la Red Nacional BACOVA que describe un aumento en la frecuencia de levaduras en usuarias de ACO, asociadas a EVB con RIV (II-V) 69,7%.12
La exposición a ACO produce aumento del contenido de glucógeno epitelial, reduce la infiltración de leucocitos y reduce la actividad antifúngica del epitelio celular. Estos cambios garantizan una buena concentración de lactobacilos, pero también podrían explicar la presencia de levaduras en cultivos vaginales de mujeres con ACO.13 Además de estos efectos sobre el huésped, el estrógeno promueve respuestas adaptativas en Candida spp. que inducen la evasión del sistema inmunitario innato a través de la inhibición de opsonización mediada por complemento dependiente de Gpd2 (glycerol-3-phosphate dehydrogenase 2). Además, los estrógenos inician la metaplasia del epitelio columnar a escamoso estratificado favoreciendo la adherencia y promoviendo el crecimiento de Candida albicans. 14
Conforme a nuestro estudio el 3,5% de usuarias de ACO presentó trichomoniasis. Resultados similares fueron observados por Brahmbhatt et al. 15 quienes refieren una prevalencia de T. vaginalis del 4,0%.
En nuestra cohorte se observó un 42,1% de desbalance de la microbiota vaginal en las usuarias de preservativo. Belchior et al.12 relatan que el preservativo masculino se asoció positivamente con el EVB de vaginosis (OR 1,34 – IC95% 1,12-1,60). Mientras que Bradshaw et al.16 observaron que el preservativo tiene un comportamiento dual sobre la presencia de VB dependiendo de la utilización correcta. Según este estudio, el uso correcto presentó una asociación negativa con VB (OR 0,96 IC95% 0,64–1,43), mientras que el uso incorrecto mostró una asociación positiva con VB (OR 1,96 IC95% 1,29–2,99). Resultados similares fueron obtenidos en nuestro estudio, que evidenció una asociación con VB de 1,32 (IC95% 1,0-1,75), sin embargo, no se tomó en cuenta la utilización correcta del mismo. En contraposición, el estudio transversal de Hitchcock et al.,17 demostró que el uso de preservativo se asociaba con una disminución en el riesgo de VB.
Un estudio que analizó la distribución de levaduras en usuarias de distintos MAC encontró que las usuarias de preservativo tuvieron una asociación menor con infección sintomática de Candida spp. respecto de ACO.18 En este mismo sentido, nuestros datos reportan que las pacientes que utilizaban el preservativo como MAC tuvieron un OR de 1,14 (IC95% 0,82-1,6).
Está bien documentado el efecto protector del preservativo frente a trichomonas al evitar el contacto de secreciones.17 En una revisión sistemática se observó una baja tasa de infección por trichomonas entre usuarias de preservativo, mientras que en otros estudios, no se detectó asociación.19
El 48,9% de las pacientes usuarias de DIU-Cu tuvieron desbalance de la microbiota. Belchior et al.,12 refieren su asociación con el desbalance de la microbiota vaginal, tanto en el EVB IV (OR 1,32 IC95% 0,98-1,76) como en el EVB V (OR 2,34 IC95% 1,74-3,12). Este desbalance podría explicarse porque al representar un cuerpo extraño que permanece largos períodos de tiempo, se modifica el ecosistema vaginal. Asimismo, nuestro estudio detectó 41,3% de VB en usuarias de DIU-Cu. Un estudio longitudinal estimó la prevalencia asintomática de VB, demostrando un aumento de VB del 27 % al inicio (cuando se coloca del DIU-Cu), al 35 % a los 30 días, al 40 % a los 90 días y al 49 % a los 180 días.3 También reportaron una mayor colonización por Gardnerella vaginalis y Atopobium vaginae.3
Además, nuestro estudio describió un aumento de la prevalencia de levaduras en pacientes usuarias de DIU-Cu 31,5%, con un predominio de estados inflamatorios (82,8%). En coincidencia con estos resultados algunos estudios encontraron que la incidencia de colonización y vulvovaginitis por Candida spp. es mayor en usuarias de DIU-Cu.20 Se ha sugerido que esta asociación del DIU con vulvovaginitis se debe a la adhesión de las levaduras y formación de biopelículas en la superficie del dispositivo. Una biopelícula es una comunidad de microorganismos asociados a la superficie, inmersos en una matriz extracelular de producción que confiere resistencia a los antifúngicos, la inmunidad del huésped y el estrés. Las levaduras pueden formar biopelículas en las superficies inertes de varios dispositivos implantados, incluidos catéteres, válvulas cardíacas protésicas y DIU-Cu.21
La prevalencia de trichomonas en nuestra serie fue de 2,2% en usuarias de DIU-Cu. Estas cifras son menores a las referidas en un estudio de Uganda en donde se comunicaron tasas más altas de T. vaginalis entre las usuarias de DIU-Cu. 22
Existe poca evidencia sobre esta asociación, aunque probablemente pueda deberse al aumento del sangrado menstrual asociado al DIU-Cu que favorece la supervivencia del parásito. Otro posible mecanismo causal son los cambios de desbalance de la microbiota que genera el DIU-Cu.22
Nuestros resultados describen que las pacientes usuarias de DIU-Cu mostraron un incremento significativo de los EVB con RIV (58,7%). Hallazgos similares fueron referidos por un estudio que evaluó los resultados citológicos de las pacientes usuarias de DIU-Cu y que constató que la infiltración inflamatoria fue significativamente más frecuente en los grupos SIU-LNG (54,9%) y DIU-Cu (57,2%) que en el grupo control (50,2%).23
La LT es un método de anticoncepción quirúrgico permanente para las mujeres. No existen prácticamente datos sobre su influencia en el desbalance de la microbiota vaginal. En nuestra investigación, se detectó un incremento en la prevalencia de VB (50%) y de levaduras (38,5%) en las pacientes con LT. De manera similar, el estudio realizado por Riggs et al. 24, en pacientes con LT mostró VB en la mayoría de sus casos (66%).
Nuestro estudio detectó una prevalencia de 7,7% de infección por T. vaginalis en las pacientes con LT. Sin embargo, según los datos proporcionados por Nikpay et al.,25 las pacientes que utilizaron la LT como MAC tuvieron prevalencias mayores de infección por trichomonas.
En nuestra casuística relatamos una prevalencia de 42,3% de estados con RIV (Estados II/V) en las pacientes con LT. Resultados similares fueron descritos por Garg et al.26 en India, quienes describieron que la RIV de las pacientes sometidas a LT estuvo presente en el 41%.
Conclusiones
Se observó mayor desbalance de la microbiota vaginal en las pacientes usuarias de DIU-Cu respecto del control. En cambio, en las usuarias de ACO predominó el balance de la microbiota por el aporte hormonal. Se observó mayor prevalencia de VB en las usuarias de DIU-Cu y tendencia en las usuarias de preservativo y LT respecto del control. Se observó mayor prevalencia de levaduras en el grupo de DIU-Cu y LT, sin embargo, el DIU-Cu fue el único método en donde este germen se asoció a RIV. No se observaron diferencias significativas en las prevalencias de trichomonas en los distintos grupos de estudio. También se observó que las usuarias de DIU-Cu presentaron una mayor RIV que el control por ser un cuerpo extraño.
Financiación
El presente trabajo ha sido financiado por un proyecto de la Universidad de Buenos Aires (UBA) Proyecto UBACYT-20020150200194BA.
Conflicto de interés: Ninguno
Bibliografía
- Cauci, S., Driussi, S., De Santo, D., Penacchioni, P., Iannicelli, T., Lanzafame, P., et al. Prevalence of bacterial vaginosis and vaginal flora changes in peri- and postmenopausal women. Journal of clinical microbiology (2002), 40(6), 2147–2152.
- Petricevic, L., Domig, K. J., Nierscher, F. J., Krondorfer, I., Janitschek, C., Kneifel, W., et al. Characterization of the oral, vaginal and rectal Lactobacillus flora in healthy pregnant and postmenopausal women. European journal of obstetrics, gynecology, and reproductive biology (2012), 160(1), 93–99.
- Achilles, S. L., Austin, M. N., Meyn, L. A., Mhlanga, F., Chirenje, Z. M., & Hillier, S. L. Impact of contraceptive initiation on vaginal microbiota. American journal of obstetrics and gynecology (2018), 218(6), 622.e1–622.e10.
- Ministerio de Salud de la Nación Argentina (2013). Encuesta Nacional sobre Salud Sexual y Reproductiva. Documento de Trabajo N° 1: Acceso y uso de métodos anticonceptivos. Mujeres de 14 a 49 años.
- De Seta F, Restaino S, De Santo D, Stabile G, Banco R, et al. Effects of hormonal contraception on vaginal flora. Contraception (2012) 86: 526–529
- Poch, F., Levin, D., Levin, S., & Dan, M. Modified thioglycolate medium: a simple and reliable means for detection of Trichomonas vaginalis. Journal of clinical microbiology (1996), 34(10), 2630–2631.
- Perazzi, B. E., Menghi, C. I., Coppolillo, E. F., Gatta, C., Eliseth, M. C., de Torres, R. A., et al. Prevalence and comparison of diagnostic methods for Trichomonas vaginalis infection in pregnant women in Argentina. The Korean journal of parasitology (2010), 48(1), 61–65.
- Nugent, R. P., Krohn, M. A., & Hillier, S. L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. Journal of clinical microbiology (1991), 29(2), 297–301.
- Proyecto BACOVA, Programa PROSAR, Fundación Bioquímica Argentina. Manual de Procedimientos BACOVA 2018. Disponible en: http://www.fba.org.ar/PROSAR Discusión LTB file:///C:/Users/Usuario/Downloads/Longitudinal_Association_Between_Hormonal.4.pdf
- Vodstrcil, L. A., Hocking, J. S., Law, M., Walker, S., Tabrizi, S. N., Fairley, C. K., et al. Hormonal contraception is associated with a reduced risk of bacterial vaginosis: a systematic review and meta-analysis (2013). PloS one, 8(9), e73055.
- Fosch, S. E., Ficoseco, C. A., Marchesi, A., Cocucci, S., Nader-Macias, M. E. F., & Perazzi, B. E. Contraception: Influence on Vaginal Microbiota and Identification of Vaginal Lactobacilli Using MALDI-TOF MS and 16S rDNA Sequencing. The open microbiology journal (2018), 12, 218–229.
- Belchior, S., Fosch, S., Yones, C., de Torres, R. Palaoro, L., Micucci, H., et al. Estudio multicéntrico de disfunción vaginal de la Red Nacional de Laboratorios BACOVA de la República Argentina: prevalencia, influencia de factores seleccionados, evaluación clínica y distribución de casos por región. Acta bioquímica clínica latinoamericana (2021), 55(Supl. 1), 49-50.
- van de Wijgert, J. H., Verwijs, M. C., Turner, A. N., & Morrison, C. S. Hormonal contraception decreases bacterial vaginosis but oral contraception may increase candidiasis: implications for HIV transmission. AIDS (London, England) (2013), 27(13), 2141–2153.
- Kumwenda, P., Cottier, F., Hendry, A. C., Kneafsey, D., Keevan, B., Gallagher, H., et al. Estrogen promotes innate immune evasion of Candida albicans through inactivation of the alternative complement system. Cell reports (2022), 38(1), 110183.
- Brahmbhatt, H., Musoke, R., Makumbi, F., Kigozi, G.. Serwadda D, Wawer M, et al. Trichomonas vaginalis Incidence Associated with Hormonal Contraceptive Use and HIV Infection among Women in Rakai, Uganda. Journal of sexually transmitted diseases, 2014, 916597.
- Bradshaw, C. S., Vodstrcil, L. A., Hocking, J. S., Law, M., Pirotta, M., Garland, S. M., et al. Recurrence of bacterial vaginosis is significantly associated with posttreatment sexual activities and hormonal contraceptive use. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America (2013), 56(6), 777–786.
- Hitchcock P. Scientific evidence on condom effectiveness for sexually transmitted disease (STD) prevention: workshop summary. Herndon (Va): Diane Publishing, 2001, p.12-3.
- Cetin, M., Ocak, S., Gungoren, A., & Hakverdi, A. U. Distribution of Candida species in women with vulvovaginal symptoms and their association with different ages and contraceptive methods. Scandinavian journal of infectious diseases (2007), 39(6-7), 584–588.
- Arbabi, M., Delavari, M., Fakhrieh-Kashan, Z., & Hooshyar, H. Review of Trichomonas vaginalis in Iran, Based on Epidemiological Situation. Journal of reproduction & infertility (2018), 19(2), 82–88.
- Borges, K. R. A., Pimentel, I. V., Lucena, L. C. L. D. S., Silva, M. A. C. N. D., Monteiro, S. G., Monteiro, C. A., et al. Adhesion and biofilm formation of Candida parapsilosis isolated from vaginal secretions to copper intrauterine devices. Revista do Instituto de Medicina Tropical de Sao Paulo (2018), 60, e59.
- Gonçalves, B., Ferreira, C., Alves, C. T., Henriques, M., Azeredo, J., & Silva, S. Vulvovaginal candidiasis: Epidemiology, microbiology and risk factors. Critical reviews in microbiology (2016). , 42(6), 905–927.
- Kiweewa, F. M., Brown, E., Mishra, A., Nair, G., Palanee-Phillips, T., Mgodi, N., & MTN-020/ASPIRE Study Team. Acquisition of Sexually Transmitted Infections among Women Using a Variety of Contraceptive Options: A prospective Study among High-risk African Women. Journal of the International AIDS Society (2019), 22(2), e25257.
- Eleuterio, J., Junior, Giraldo, P. C., Silveira Gonçalves, A. K., & Nunes Eleuterio, R. M. Liquid-based cervical cytology and microbiological analyses in women using cooper intrauterine device and levonorgestrel-releasing intrauterine system. European journal of obstetrics, gynecology, and reproductive biology (2020), 255, 20–24.
- Riggs, M., Klebanoff, M., Nansel, T., Zhang, J., Schwebke, J., & Andrews, W. Longitudinal association between hormonal contraceptives and bacterial vaginosis in women of reproductive age. Sexually transmitted diseases (2007), 34(12), 954–959.
- Nikpay, S., Otaghi, M., Azami, M., Karimi, M., & Abdi, J. Trichomonas Vaginalis. Infection Among Women Attending Laboratory Centers in Ilam, Iran. Infectious disorders drug targets (2020), 20(1), 98–101.
- Garg, K., Khare, A., Bansal, R., Sharma, S., & Chaudhary, N. Effects of Different Contraceptive Methods on Cervico-Vaginal Cytology. Journal of clinical and diagnostic research : JCDR(2017), 11(7), EC09–EC11.
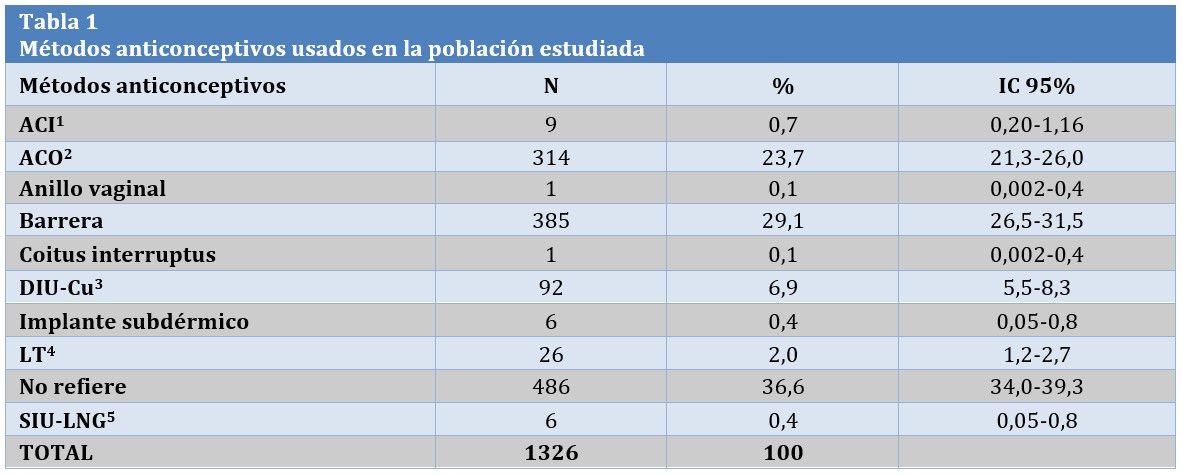
TABLA 1: 1 ACI: Anticonceptivo Inyectable 2 ACO: Anticonceptivo Oral 3 DIU-Cu: Dispositivo Intrauterino de Cobre 4 LT: Ligadura Tubaria 5 SIU-LNG: Sistema Intrauterino de levonogestrel
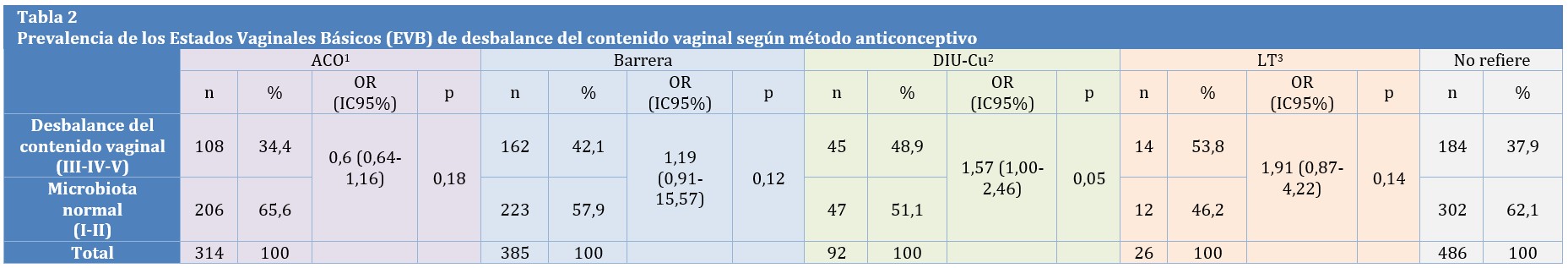
Tabla 2: 1 ACO: Anticonceptivo Oral 2 DIU-Cu: Dispositivo Intrauterino de Cobre 3 LT: Ligadura Tubaria
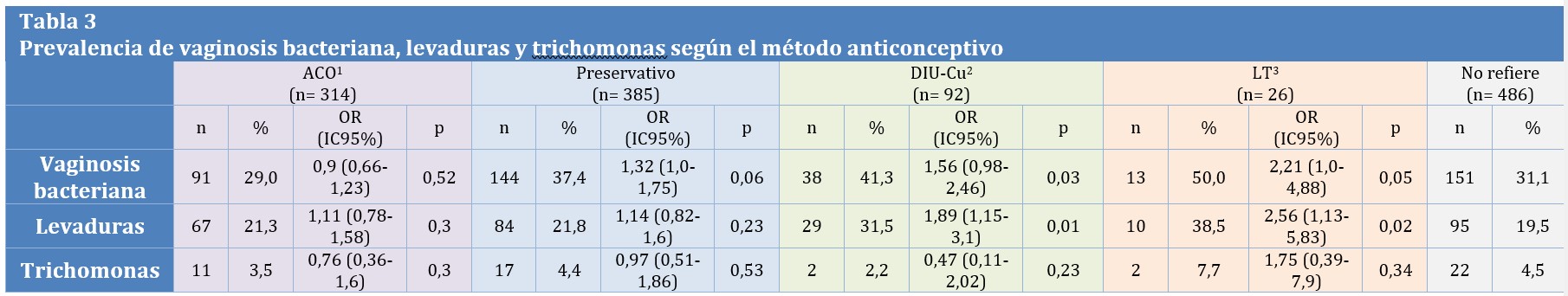
Tabla 3: 1 ACO: Anticonceptivo Oral 2 DIU-Cu: Dispositivo Intrauterino de Cobre 3 LT: Ligadura Tubaria
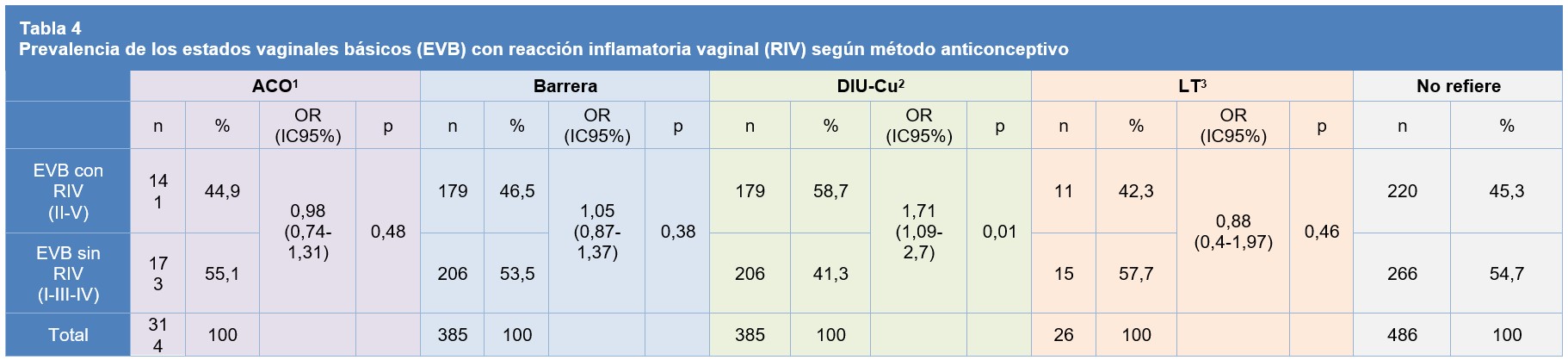
Tabla 4: 1 ACO: Anticonceptivo Oral 2 DIU-Cu: Dispositivo Intrauterino de Cobre 3 LT: Ligadura Tubaria
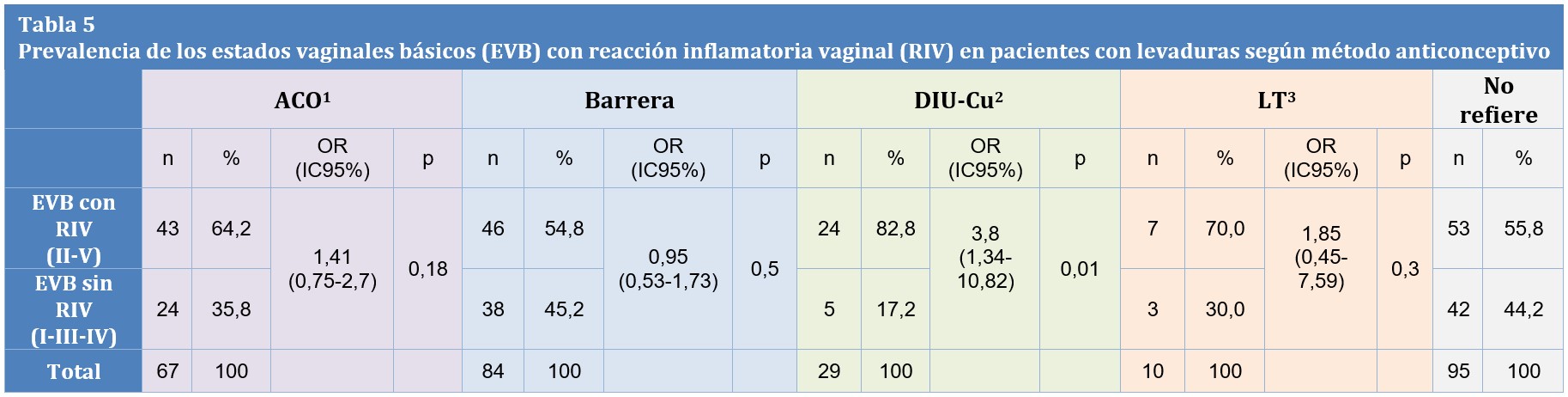
Tabla 5: 1 ACO: Anticonceptivo Oral 2 DIU-Cu: Dispositivo Intrauterino de Cobre 3 LT: Ligadura Tubaria



