Contenido de esperma bajo o inexistente en la preeyaculación, uso perfecto del coito interrumpido como anticonceptivo, un estudio piloto
Low to non-existent sperm content of pre-ejaculate in perfect-use contraceptive withdrawal, a pilot study
 Autores: Jasmine Patel, Anita L. Nelson, Brian T. Nguyen
Autores: Jasmine Patel, Anita L. Nelson, Brian T. Nguyen
https://doi.org/10.1016/j.contraception.2024.110555
Traducción y revisión de la bibliografía
Dra. Elina Coccio, médica ginecóloga del Hospital Rivadavia
Mail: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
El coito interrumpido (coitus interruptus; CI) o método de la retirada es considerado un método anticonceptivo de baja eficacia anticonceptiva y no recomendado por los profesionales de la salud, siendo ofrecidos métodos más eficaces como la anticoncepción intrauterina y la hormonal. 1
Sin embargo, tanto hombres como mujeres suelen recurrir al CI para evitar el embarazo. La Encuesta Nacional de Crecimiento Familiar (NSFG), realizada en 2016, que evaluó hábitos sexuales y anticonceptivos de las mujeres en edad reproductiva reveló que el 7% de las mujeres y el 18.8 % de los hombres solteros utilizaban exclusivamente el CI como método anticonceptivo.2
Muchos estudios muestran que el CI se utiliza como método complementario o de respaldo. 3-4-5. Y debido a que este es un método comúnmente usado, se necesita más evidencia para asesorar con precisión sobre este tipo de método anticonceptivo.
La retirada, el acto de retirar el pene de la vagina antes de la eyaculación, cuando se utiliza como único método anticonceptivo, conlleva un riesgo de embarazo de uso típico del 20%.6
Sin embargo, no existen estimaciones de uso perfecto basadas en evidencia del riesgo de embarazo para el CI. Las tasas de embarazo que se citan (4%) se derivan de cálculos teóricos basados en la presunta presencia de espermatozoides en el líquido preeyaculatorio. 7
Si se define el líquido preeyaculatorio como el volumen de secreciones lubricantes producidas por las glándulas de Littre o Cowper antes de la eyaculación, no deberían encontrarse espermatozoides en los líquidos preeyaculatorios. Sin embargo, los estudios que examinan el contenido de espermatozoides del líquido preeyaculatorio ofrecen hallazgos contradictorios.8 Para aumentar esta controversia, los estudios históricos realizados y las metodologías utilizadas, no lograron una investigación a fondo en relación a que la presencia de espermatozoides en algunos casos podría haberse explicado por la contaminación y la recolección imperfecta. Estos estudios tampoco evaluaron la motilidad de los espermatozoides o si los espermatozoides estaban presentes en cantidad suficiente para la fertilización.9-10 En consecuencia, los intentos de extrapolar el riesgo de embarazo basándose únicamente en la presencia de espermatozoides pueden sobreestimar el riesgo de falla anticonceptiva con la utilización del CI de uso perfecto.
Son esenciales estudios más específicos del contenido de espermatozoides preseminales para transmitir con mayor precisión el riesgo de embarazo asociado con el uso de la retirada como método anticonceptivo, si este método se utilizara de manera correcta y constante.
En el trabajo de Patel y col. se evalúa la presencia, la motilidad y la consistencia de los espermatozoides preseminales de muestras, mediante una recolección perfecta de hombres sanos. Además, se exploran posibles asociaciones entre la presencia de espermatozoides preseminales y las características o conductas relevantes de los participantes. Queda planteada la hipótesis de que el esperma preseminal no contendrá suficientes espermatozoides móviles para conferir un riesgo de embarazo clínico significativo, definido como >1 millón de espermatozoides por ml.
Para determinar el riesgo de esperma en la pre-eyaculación relacionado con la abstinencia cuando se utiliza perfectamente para anticoncepción, se llevó a cabo un estudio observacional, buscando:
- identificar esperma móvil en muestras de preeyaculación recolectadas a través de la masturbación en concentraciones > 1millón/ml.
- confirmar la consistencia de su presencia dentro de los individuos
- explorar la asociación de las características de los participantes y los factores de comportamiento con la presencia de espermatozoides en el líquido preeyaculado.
Para este estudio se reclutaron participantes varones sanos, de entre 18 y 50 años, que informaron haber usado alguna vez el coito interrumpido como método anticonceptivo. Las estrategias de reclutamiento aprobadas por la Junta de Revisión Institucional de la Universidad del Sur de California incluyen volantes en lugares públicos y clínicas, correos electrónicos y redes sociales. Los participantes recibieron una compensación graduada según el nivel de participación (por ejemplo, número de muestras proporcionadas). Los criterios de exclusión incluyeron hombres con sospecha de recuento bajo de espermatozoides (es decir, infertilidad o vasectomía), deterioro neurológico conocido, eyaculación precoz, incontinencia urinaria y anomalías genitourinarias.
Los participantes completaron una encuesta en línea sobre sus antecedentes médicos, quirúrgicos y reproductivos. Se realizaron preguntas específicas sobre el consumo de tabaco, el traumatismo genital y los antecedentes de infecciones de transmisión sexual (ITS), dada la posibilidad de que el daño ciliar del conducto deferente contribuya a la presencia de espermatozoides en el líquido preseminal. Para evaluar los factores de comportamiento potencialmente vinculados con la presencia o ausencia de espermatozoides en el líquido preseminal, también se interrogó sobre el consumo de alcohol, la experiencia de abstinencia, la experiencia sexual y el tiempo con la pareja actual. Todas las encuestas y los datos se realizaron utilizando la base de datos de captura electrónica de datos de investigación (REDCap) del Southern California Clinical and Translational Science Institute (SC CTSI).13-14
Los participantes proporcionaron hasta tres pares de muestras de preeyaculación y eyaculaciones obtenidas mediante masturbación, cada una de ellas recogida en el consultorio clínico al menos 72 horas después de la última eyaculación. Se les indicó a los participantes que primero orinaran, luego recolectan toda la preeyaculación presionando la punta del pene contra una placa de Petri de vidrio, repetidamente durante la masturbación y, antes de su percepción de eyaculación inminente, retiraran el pene para eyacular en un recipiente para muestras por separado. Cada hombre verificó si su recolección representaba una "retirada perfecta", es decir, una recolección en la que la preeyaculación no estaba contaminada con líquido eyaculatorio. Si bien las parejas femeninas podían facilitar la recolección de muestras, los participantes recibieron instrucciones de evitar el uso de cualquier lubricante o el contacto genital.
Se agregó solución salina con fosfato a las muestras de preeyaculación de bajo volumen para facilitar la transferencia desde las placas de Petri. El investigador principal analizó todas las muestras para determinar el volumen de líquido, la presencia, la concentración, el recuento y la motilidad de los espermatozoides dentro de los cinco minutos posteriores a la recolección según el Manual de laboratorio de la OMS para el examen y procesamiento del semen humano15 y se realizó mediante recuento manual. Para las mediciones de muestras diluidas, se realizaron ajustes correspondientes para el factor de dilución.
Se realizó el cálculo de la proporción de muestras de individuos cuyas muestras de preeyaculación contenían esperma. En el caso de aquellos individuos cuyas muestras de preeyaculación contenían esperma, se verificó si todas las muestras aportadas contenían esperma de manera consistente. Se estableció el resultado principal como riesgo de embarazo clínicamente significativo, definido como una concentración de esperma > 1 millón/ml, un valor de corte informado por datos de ensayos clínicos de anticonceptivos hormonales masculinos que demostraron una eficacia anticonceptiva comparable a la de los anticonceptivos hormonales combinados femeninos (<1%) con oligozoospermia grave de ≤ 1 millón/ml.16
El recuento total de espermatozoides móviles (RTEM TMSC) en una cantidad de más de 3 millones se utilizó como resultado secundario, dada su fuerte correlación con el embarazo espontáneo.17 Se observó que el recuento total de espermatozoides móviles puede ser más relevante que la concentración de espermatozoides para los estudios sobre el líquido preeyaculatorio dados los pequeños volúmenes encontrados.
Se reclutó un grupo racialmente diverso de 24 participantes varones sexualmente activos (edad media: 27 años, rango: 19-35); la mayoría informó que su estado civil era soltero (87,5%) y tenía una experiencia sexual media de 9 años. Casi un tercio (7/23; 30,4%) informó que utilizaba el coito interrumpido como su único método anticonceptivo. Los participantes tenían una media de 1,5 años (rango: 0,1-12 años) de experiencia con el método.
Se pudieron analizar un total de 70 muestras pareadas para el análisis. Sin embargo, los análisis bivariados solo incluyeron 23 participantes con tres muestras pareadas cada uno.
Solo siete muestras (10%) cumplieron con el resultado primario con concentraciones de esperma que se presume que confieren un riesgo significativo de embarazo clínico (> 1 millones/ml). Sin embargo, ninguna muestra de preeyaculación cumplió con el resultado secundario de recuento total de espermatozoides móviles > 3 millones dados los pequeños volúmenes de líquido preseminal. Exactamente 61/70 (87,1%) de las muestras de líquido preseminal no contienen espermatozoides, mientras que 2 tenían concentraciones de 0 a 1 millón/ml. Casi tres cuartas partes (73,9%) de los participantes no tenían espermatozoides en ninguna de sus muestras de líquido preseminal.
Los factores que se observaron como estadísticamente significativos asociados con el contenido de esperma en el líquido preseminal (p < 0,05) incluyeron: estar casado y tener antecedentes de infecciones de transmisión sexual; no se asociaron ni los años de experiencia en el uso de la abstinencia ni los años con su pareja sexual actual. Las asociaciones anteriores se mantuvieron incluso cuando se excluyó al participante con oligozoospermia identificada en las muestras de eyaculación.
Por lo tanto, este método ampliamente utilizado, pero poco reportado puede reducir el riesgo de embarazo si se usa de manera correcta y constante, ya que los espermatozoides no existen en cantidades suficientes en el líquido preseminal incluso cuando están presentes. El asesoramiento médico debe reflejar mejor esta evaluación del riesgo de embarazo; el coito interrumpido debe desestigmatizar como método anticonceptivo. El desarrollo de una prueba de producción masiva para la identificación de espermatozoides preseminales, como los kits de espermatozoides post vasectomía y anticonceptivos masculinos,20 puede ayudar a las personas a usar este método anticonceptivo con más éxito. Analizar solo una muestra puede ser suficiente para identificar a la mayoría de los hombres que pueden usar la retirada como método anticonceptivo. Se necesitan más estudios que exploren las posibles asociaciones, incluidos los factores ambientales, con la presencia de espermatozoides en el líquido preseminal para poder asesorar con mayor precisión a los pacientes que optan por utilizar este método conductual de anticoncepción.
La necesidad de delimitar cada vez más las características seminales, tanto del varón fértil como infértil, ha dado lugar a que la Organización Mundial de la Salud (OMS) haya publicado sucesivas ediciones del “Manual para el examen y procesamiento del semen humano”. La del año 2021 (sexta edición) es la que se encuentra vigente en estos momentos. Este manual sirve de guía en los laboratorios de andrología, estandarizando el método de evaluación de la calidad seminal.21
En la última actualización del manual de la OMS se ha ampliado el número de varones estudiados, así como el número de países del que proceden (12 países de 5 continentes). En esta sexta edición no se habla de valores de referencia para los parámetros espermáticos de concentración, motilidad, vitalidad y morfología, ya que estos valores no determinan con claridad si el varón es fértil o infértil. Lo que el manual propone es trabajar con “límites de decisión”, al estar basados en la evidencia científica. Además, la OMS establece que cada laboratorio establezca los límites, o valores de referencia, que considere más adecuados.
En la tabla 1 se muestran los valores medios obtenidos tras el análisis de las muestras seminales de los varones incluidos en el estudio, divididos en percentiles.
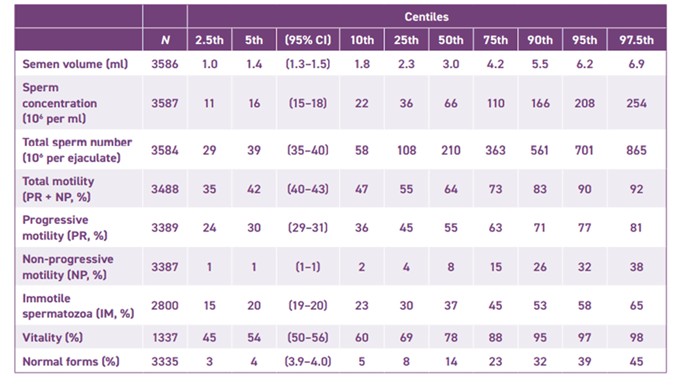
Tabla 1
En conclusión, la última revisión de la OMS considera dentro de parámetros de normalidad un volumen seminal de 2,0 ml o más, una concentración espermática de 20 millones o más de espermatozoides por ml., con un número total de espermatozoides de 40 millones o más por eyaculado. En relación con la motilidad, 50% o más con progresión anterógrada (categorías A y B), o 25% o más con progresión lineal rápida (categoría A) dentro de los 60 minutos de la eyaculación.
Por otro lado en los trabajos en que evaluaron la seguridad y eficacia anticonceptiva del gel transdérmico que contiene una progestina (Nestorone, NES) se determinó la tasa de embarazo en relación a la concentración de espermatozoides ≤ 1 millón/ml, siendo este el momento en el que la pareja comenzaba a utilizar el gel como único método anticonceptivo. Los ensayos de eficacia anteriores de prototipos de anticonceptivos hormonales masculinos en parejas han demostrado que la concentración de espermatozoides ≤ 1 millón/ml (independientemente de la motilidad) es suficiente para prevenir el embarazo en la pareja femenina a tasas iguales o mejores que las tasas de fracaso del uso típico de las píldoras aprobadas para la anticoncepción femenina. 22-23-24-25-26-27-28-29 En estudios previos, la motilidad de los espermatozoides se suprimió notablemente cuando la concentración era ≤1,0 millones/ml, lo que hizo innecesaria la evaluación de la motilidad.30-31-32
A su vez, las pautas de vasectomía de la Asociación Urológica Estadounidense, la Sociedad Británica de Cirujanos Urológicos y la Sociedad Británica de Andrología establecen que la vasectomía es exitosa si hay ≤0,1 millones de espermatozoides no móviles/ml en las muestras de semen posteriores a la vasectomía.33-34 No se dispone de estudios sobre el riesgo de embarazo después de la vasectomía utilizando umbrales >0,1 millones de espermatozoides móviles/ml. Un informe reciente sobre la medición de la concentración de espermatozoides en más de 9000 muestras de semen indicó que utilizando el Manual de laboratorio de la OMS para el examen y procesamiento del semen humano fue lo suficientemente robusto como para confirmar el éxito de la vasectomía y los esfuerzos por detectar espermatozoides móviles ocasionales fueron inútiles. Otro estudio cuestionó el requisito de evaluar la motilidad de los espermatozoides en los análisis de semen post vasectomía (más de 6000 muestras de semen post vasectomía) dada la baja probabilidad de encontrar espermatozoides móviles en concentraciones muy bajas de espermatozoides (cuando la concentración de espermatozoides era <1 millón/ml o <0,25 millones/ml, solo el 0,5% y el 0,3% de las muestras tenían espermatozoides móviles, respectivamente Es probable que la estimación de la concentración de espermatozoides en ≤ 0,1 millones/ml sin evaluación de la motilidad sea suficiente para clasificar el éxito o el fracaso de la vasectomía. Sin embargo, las pautas que definen el fracaso de la vasectomía pueden no ser aplicables al desarrollo de anticonceptivos masculinos en los que la espermatogénesis está marcadamente suprimida por un mecanismo hormonal, y los estudios muestran que los umbrales altos de hasta <1 millón/ml proporcionan una eficacia anticonceptiva efectiva. 35
Referencias
- Cason, C. Cwiak, A. Edelman, D. Kowal, J. Marrazzo, A. Nelson. Contraceptive technology (22nd ed.,), Jones & Bartlett, Burlington, MA (2023), p. [2]
- L. Kavanaugh, E. Pliskin. Use of contraception among reproductive-aged women in the United States, 2014 and 2016 F&S Rep, 1 (2020), pp. 83-93
- Daniels K, Abma JC. Unmarried men’s contraceptive use at recent sexual intercourse: United States, 2011–2015. 2011.
- G. Whittaker, R.D. Merkh, D. Henry-Moss, L. Hock-Long. Withdrawal attitudes and experiences: a qualitative perspective among young urban adults. Perspect Sex Reprod Health, 42 (2010), pp. 102-109
- Ong, M. Temple‐Smith, W. Wong, K. McNamee, C. Fairley. Prevalence of and characteristics associated with use of withdrawal among women in Victoria, Australia.Perspect Sex Reprod Health, 45 (2013), pp. 74-78.
- Sundaram, B. Vaughan, K. Kost, A. Bankole, L. Finer, S. Singh, et al. Contraceptive failure in the United States: estimates from the 2006-2010 National Survey of Family Growth. Perspect Sex Reprod Health, 49 (2017), pp. 7-16.
- J. Trussell, R. Faden, R.A. Hatcher. Efficacy information in contraceptive counseling: those little white lies. Am J Public Health, 66 (1976), pp. 761-767.
- R. Killick, C. Leary, J. Trussell, K.A. Guthrie. Sperm content of pre-ejaculatory fluid. Hum Fertil (Camb), 14 (2011), pp. 48-52.
- Ilaria, J.L. Jacobs, B. Polsky, B. Koll, P. Baron, C. Maclow, et al. Detection of HIV-1 DNA sequences in pre-ejaculatory fluid. The Lancet, 340 (8833) (1992), Article 1469.
- Pudney, M. Oneta, K. Mayer, G. Seage, D. Anderson. Pre-ejaculatory fluid as potential vector for sexual transmission of HIV-1. Lancet (1992), p. 1470
- Kovavisarach, S. Lorthanawanich, P. Muangsamran. Presence of sperm in pre-ejaculatory fluid of healthy males. J Med Assoc Thai, 99 (2016), pp. S38-S41
- Zukerman, D.B. Weiss, R. Orvieto. Does preejaculatory penile secretion originating from Cowper’s gland contain sperm. J Assist Reprod Genet, 20 (4) (2003), pp. 157-159
- A. Harris, R. Taylor, R. Thielke, J. Payne, N. Gonzalez, J.G. Conde. Research electronic data capture (REDCap)--a metadata-driven methodology and workflow process for providing translational research informatics support. J Biomed Inform, 42 (2009), pp. 377-381.
- RedCap Project. 〈Http://Project-RedcapOrg〉d.
- WHO Laboratory manual for the examination and processing of human semen. Fifth Edit. Geneva, Switzerland: 2010.
- Aaltonen, J.K. Amory, R. Anderson, H.M. Behre, G. Bialy, D. Blithe, et al. 10th Summit Meeting consensus: recommendations for regulatory approval for hormonal male contraception. J Androl, 28 (3) (2007), p. 362.
- A.M. Hamilton, M. Cissen, M. Brandes, J.M.J. Smeenk, J.P. De Bruin, J.A.M. Kremer, et al. Total motile sperm count: a better indicator for the severity of male factor infertility than the WHO sperm classification system. Hum Reprod, 30 (2015), pp. 1110-1121.
- R. Small, J.A. Collins, E.H. Wilson, W. Wrixon. Interpretation of semen analysis among infertile couples. CMAJ, 136 (8) (1987), pp. 829-833.
- Ayala, E. Steinberger, D.P. Smith. The influence of semen analysis parameters on the fertility potential of infertile couples J Androl, 17 (6) (1996), pp. 718-725.
- Lue Y, Swerdloff R, Pak Y, Nguyen BT, Yuen F, Liu PY, et al. Male contraception development: monitoring effective spermatogenesis suppression utilizing a user-controlled sperm concentration test compared with standard semen analysis HHS public access. n.d.
- World Health Organization. «WHO Laboratory Manual for the examination and processing of human semen» Cambridge: Cambridge University. sixth Edition (2021).
- Contraceptive efficacy of testosterone-induced azoospermia in normal men. World Health Organization Task Force on methods for the regulation of male fertility.Lancet, 336 (1990), pp. 955-959
- World Health Organization Task Force on the Regulation of Male Fertility. Contraceptive efficacy of testosterone-induced azoospermia and oligozoospermia in normal men. Fertil Steril, 65 (1996), pp. 821-829
- Turner, A.J. Conway, M. Jimenez, P.Y. Liu, E. Forbes, R.I. McLachlan, et al.Contraceptive efficacy of a depot progestin and androgen combination in men. J Clin Endocrinol Metab, 88 (2003), pp. 4659-4667
- Q. Gu, X.H. Wang, D. Xu, L. Peng, L.F. Cheng, M.K. Huang, et al. A multicenter contraceptive efficacy study of injectable testosterone undecanoate in healthy Chinese men.J Clin Endocrinol Metab, 88 (2003), pp. 562-568
- Gu, X. Liang, W. Wu, M. Liu, S. Song, L. Cheng, et al. Multicenter contraceptive efficacy trial of injectable testosterone undecanoate in Chinese men. J Clin Endocrinol Metab, 94 (2009), pp. 1910-1915
- M. Behre, M. Zitzmann, R.A. Anderson, D.J. Handelsman, S.W. Lestari, R.I. McLachlan, et al. Efficacy and safety of an injectable combination hormonal contraceptive for men. J Clin Endocrinol Metab, 101 (2016), pp. 4779-4788
- Aaltonen, J.K. Amory, R.A. Anderson, H.M. Behre, G. Bialy, D. Blithe, et al. 10th Summit Meeting consensus: recommendations for regulatory approval for hormonal male contraception. J Androl, 28 (2007), pp. 362-363
- Sundaram, B. Vaughan, K. Kost, A. Bankole, L. Finer, S. Singh, et al. Contraceptive failure in the United States: estimates from the 2006-2010 national survey of family growth. Perspect Sex Reprod Health, 49 (2017), pp. 7-16
- Ilani, M.Y. Roth, J.K. Amory, R.S. Swerdloff, C. Dart, S.T. Page, et al. A new combination of testosterone and nestorone transdermal gels for male hormonal contraception. J Clin Endocrinol Metab, 97 (2012), pp. 3476-3486
- T. Gonzalo, R.S. Swerdloff, A.L. Nelson, B. Clevenger, R. Garcia, N. Berman, et al. Levonorgestrel implants (Norplant II) for male contraception clinical trials: combination with transdermal and injectable testosterone. J Clin Endocrinol Metab, 87 (2002), pp. 3562-3572
- Kamischke, T. Heuermann, K. Krüger, S. von.Eckardstein, I. Schellschmidt, A. Rübig, et al. An effective hormonal male contraceptive using testosterone undecanoate with oral or injectable norethisterone preparations. J Clin Endocrinol Metab, 87 (2002), pp. 530-539
- M. Sharlip, A.M. Belker, S. Honig, M. Labrecque, J.L. Marmar, L.S. Ross, et al. AUA clinical guideline: vasectomy Available at https://wwwauanetorg/guidelines/vasectomy-(2012-reviewed-for-currency-2015(2015). Accessed August 7, 2022.
- Hancock, B.J. Woodward, A. Muneer, J.C. Kirkman-Brown. 2016 Laboratory guidelines for postvasectomy semen analysis: Association of Biomedical Andrologists, the British Andrology Society and the British Association of Urological Surgeons. J Clin Pathol. 69 (2016), pp. 655-660
- McMartin, P. Lehouillier, J. Cloutier, N. Singbo, M. Labrecque. Can a low sperm concentration without assessing motility confirm vasectomy success? A retrospective descriptive study. J Urol, 206 (2021), pp. 109-114



