Estetrol (E4) en Anticoncepción
Novedades del 14th Congres of the European Society of Contraception and Reproductive Health, Basilea, Suiza, 4 al 7 de mayo de 2016
La siguiente presentación es un resumen de las exposiciones de los Doctores.L. Shulman (USA), C. Kluft (The Netherlands) y J.M. Foidart (Bélgica) que se completó con una búsqueda bibliográfica.
Dra. Silvia Bonsergent
Médica ginecóloga especialista en ginecología infantojuvenil Hospital Británico de Bs. As.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
El estetrol (E4) es un estrógeno natural cuya molécula es producida durante la vida fetal, y fue descubierta por el grupo de Egon Diczfalus en el Instituto Karolinska de Estocolmo en el año 1965. Redescubierto en 2001 para uso en humanos en los países bajos, fue probado en 2013 para su uso en anticoncepción (Estetra®) por el grupo de Jean Michel Foidart. Actualmente se encuentra en Fase III para su uso en anticoncepción en combinación monofásica 24/4 con drospirenona (Estelle®: 15mg E4/ 3mg drospirenona, DRSP) y en Fase II para tratamiento de síntomas vasomotores en el climaterio, desarrollado por Mithra Pharmacéutica. Esta combinación innovadora presenta una muy buena eficacia y tolerancia en las investigaciones realizadas.
E4 posee una baja afinidad por el receptor alfa estrogénico (ERα) compensado por una elevada biodisponibilidad oral con respecto al Estradiol (E2) y una prolongada vida media (20-28 hs). Además no se une a la proteína transportadora de esteroides sexuales (SHBG), tiene poco impacto en la producción de SHBG por el hepatocito en humanos y se excreta como sulfato o glucuronato conjugados principalmente en orina en contraste con otros estrógenos que son excretados principalmente por la bilis realizando circuito enterohepático.3, 5 Por lo tanto el E4 tendría menor impacto en la inducción enzimática a nivel hepático y menor riesgo de enfermedad biliar. No tiene metabolitos activos (no es sustrato del Citocromo P450) y se metaboliza por conjugación. El E4 es producido por el hígado fetal, cruza la barrera placentaria y se encuentra en sangre materna a las 9 semanas de gestación. Los niveles fetales son 10 a 12 veces más altos en el feto que en la madre. Es considerado un modulador selectivo de los receptores de estrógeno endógeno.7
E4 se une a ambos receptores estrogénicos α y β con 4 a 5 veces mayor afinidad por el ERα.
E4 tiene un perfil distintivo de activación del receptor α estrogénico ya que activa el ERα nuclear pero carece de efectos en el ERα de membrana, como se puede ver en la figura 1. Este efecto repercute en su particular perfil de acción ya que contribuye a su elevada eficacia en la inhibición del eje, a su escaso impacto sobre la mama y a su acción sobre el hueso y el metabolismo que analizaremos a continuación. Los ratones transgénicos que carecen de ERα de membrana son infértiles ya que no ovulan, lo que demuestra que este receptor es necesario para alcanzar la ovulación, siendo el E4 un buen candidato para su uso en anticoncepción.6
Los estudios preclínicos probaron que el E4 es eficaz para inhibir la ovulación de forma similar al Etinil Estradiol (EE). En estudios recientes Fase II (2 combinaciones de E4/DRSP y 3 combinaciones E4/LNG vs 20µg EE/ 3mg DRSP) estas combinaciones fueron investigadas por sus efectos en la inhibición de ovulación y en los biomarcadores de la hemostasia. Observándose mínimo impacto tanto en los marcadores de coagulación como en los de fibrinólisis 4, 6.
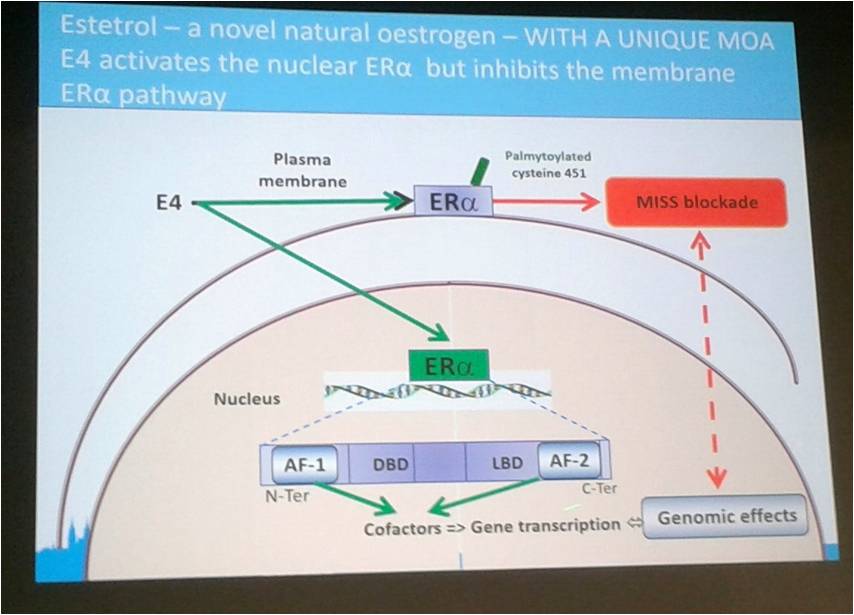
Figura 1: Extraído presentación C. Kluft.
En 2016 se están desarrollando 2 ensayos clínicos pivotales Fase III, uno en Europa y Rusia y otro en EEUU y Canadá (E4FREEDOM). Estos estudios evaluarán la eficacia anticonceptiva mediante la valoración del índice de Pearl y como objetivos secundarios la seguridad general, el patrón de sangrado y el bienestar general.
E4 posee una débil actividad estrogénica en el hígado y en el endotelio comparado con EE. Por lo tanto la combinación E4/drospirenona tiene menos efectos en las variables hemostáticas que la combinación EE/DRSP. La combinación E4 10mg/DRSP 3mg NO produce cambios hemostáticos que excedan el rango normal. DRSP parece tener un moderado efecto propio anticoagulante que se expresa en presencia de E4 el cual NO es visto cuando esta se combina con EE.8, 9 La fuerte reducción del efecto estrogénico de la combinación E4/DRSP en el hígado y el endotelio y el efecto observado anticoagulante de esta combinación sugiere un menor efecto protrombótico que deberá ser validado en futuras investigaciones (C.Kluft).
Con respecto a la función hepática y el metabolismo lipídico se ha observado un efecto dosis dependiente en las combinaciones de E4/DRSP y E4/LNG. Hubo una disminución de los niveles de SHBG en plasma con las combinaciones E4/LNG y un ligero aumento de SHBG en las combinaciones de E4/DRSP que fue mucho menor en comparación con EE20µg/DRSP 3mg, como se observa en la figura 2.
Esto se considera relevante ya que el mínimo impacto de las combinaciones de E4 sobre SHBG en comparación con EE/DRSP está relacionado con la inducción de proteínas hepáticas como los factores de coagulación. Este aumento en la SHBG plasmática que se observa con los ACO podría ser interpretado como una medida de la estrogenicidad total del compuesto y utilizado como predictor de riesgo de tromboembolismo. Si bien existe alguna controversia con respecto al uso de SHBG para predecir este riesgo, la entidad reguladora de medicamentos Europea (EMA), recomienda el dosaje de SHBG para la estimación de la seguridad trombótica de los ACO.

Figura 2: Extraído de Mawet y col.
El mismo efecto se observa con la ceruloplasmina. Esta proteína transportadora de Cobre en plasma es sintetizada por los hepatocitos bajo la influencia de los estrógenos. El aumento de los niveles plasmáticos de ceruloplasmina contribuye a aumentar el stress oxidativo observado en las usuarias de ACO. El efecto sobre la ceruloplasmina es mínimo con las combinaciones E4/DRSP (8,2% -16,1%) y con E4/LNG (entre -5,4% y 16,2%) mientras que con EE/DRSP se ve un aumento pronunciado del 69%.
Las diferencias entre los niveles plasmáticos de SHBG en las combinaciones con E4/DRSP y E4/LNG alcanzaron significancia estadística con respecto a la combinación EE/DRSP, mientras que en los niveles de ceruloplasmina la diferencia entre ambos grupos no fue significativa.1, 2, 4, 6.
En la figura 4 se observan los cambios producidos en los lípidos y lipoproteínas con las diferentes combinaciones de E4 con respecto a EE/DRSP según Mawet y col.6 Como vemos, los cambios son variables siendo la mayor diferencia a nivel de los triglicéridos (TG) donde el impacto es menor en las combinaciones con E4 a diferencia de EE/DRSP: Este efecto sería beneficioso a largo plazo ya que el aumento de TG está relacionado con aumento de riesgo metabólico y cardiovascular.
Si bien el E4 actúa como un estrógeno débil en muchos sistemas como hígado o mama tiene una potencia comparable al EE en otros sistemas como en el hueso. El estudio de Mawet y col. no detectó disbalances en el turnover óseo medidos a través del dosaje de osteocalcina y C-telopéptidos.
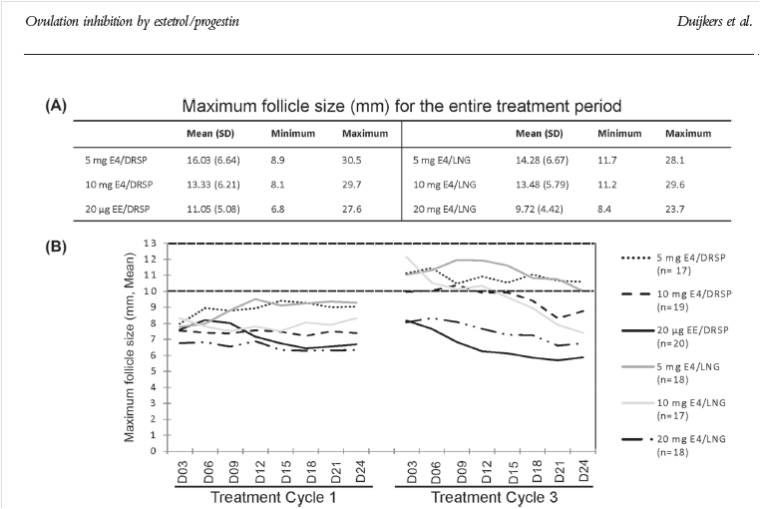
Figura 3: Valor promedio mínimo y máximo del diámetro folicular en cada grupo durante todo el período de tratamiento (A). Diámetro promedio del folículo mayor en cada grupo de tratamiento cada 3 días en el ciclo 1 y 3 (B). Extraído de Duijkers y col.
En la investigación publicada por Duijkers y col. se demostró que E4 en combinación con diferentes dosis de DRSP o LNG inhibe eficazmente la ovulación. La supresión ovárica, determinada por el diámetro máximo folicular, las concentraciones promedio y máximas de E2 y el score de Hoogland fueron adecuadas en todos los grupos de tratamiento con E4. En la figura 3 pueden observarse las variaciones en el diámetro folicular en los diferentes grupos tratados. La primera ovulación postratamiento ocurrió a los 17 días en las combinaciones de E4/ DRSP y a los 21 días promedio en las combinaciones E4/LNG. En todos los grupos tratados el período de tiempo hasta la primera ovulación fue comparable a la fase folicular normal confirmando adecuada supresión ovárica durante el tratamiento. Las diferentes combinaciones fueron seguras y bien toleradas.4
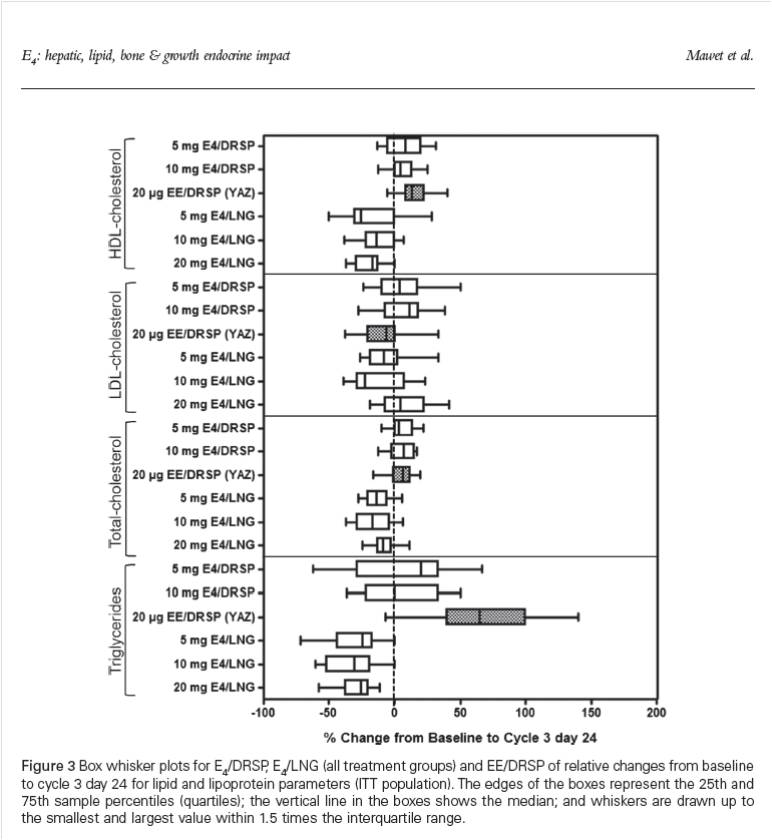
Figura 4: Extraído de Mawet y col.
E4 vs EE y E2, CONCLUSIONES:
El estetrol (E4) tendría:
- Menor interferencia con la función hepática, especialmente en los parámetros hemostáticos y posiblemente menor impacto en fenómenos trombóticos.
- Elevada biodisponibilidad oral y larga vida media lo que habilita una toma diaria.
- Menor incidencia de enfermedad hepatobiliar.
- NO inhibición del citocromo P450 a nivel hepático con menores interacciones medicamentosas con las drogas que se metabolizan por esta vía.
- Efecto anti-tumoral sobre la mama en presencia de Estradiol.
- E4 no tiene metabolitos activos en contraste con E2 cuyo metabolismo conduce a la producción de catecol-estrógenos considerados carcinogénicos.
- Perfil de buena tolerancia y eficacia anticonceptiva.
Si bien las diferencias del perfil clínico de E4 con respecto a EE son prometedoras en cuanto a su uso combinado con progestágenos para anticoncepción, son necesarios los resultados de las investigaciones de los estudios en Fase III para un mayor conocimiento con respecto al patrón de sangrado y la presencia de eventos adversos con mayor número de pacientes.
Bibliografía:
-
Apter D, et al. “Bleeding pattern and Cycle control with estetrol- containing combined oral contraceptive: Results of a Phase II, randomized, dose finding study (FIESTA). Contraception 2016, on line.
-
Bitzer J. “Pharmacological profile of estrogens in oral contraception.” Minerva Ginecol 2011 Jun; 63 (3): 299-304.
-
Coelingh Bennink HJ, et al.”Estetrol review: profile and potencial clinical applications.” Climateric 2008; 11 Suppl 1: 47-58.
-
Duijkers IJM, et al. “Inhibition of ovulation by administration of estetrol in combination with drospirenone or levonorgestrel: Results of a Phase II dose-finding pilot Study”. Eur J Cont Reprod Health Care, 2015; 20: 476-489.
-
Gerard C, et al. “Estetrol is a weak estrogen antagonizing estradiol dependent mammary gland proliferation.” Journal of Endocrinology (2015) 224: 85-95.
-
Mawet M, et al. “Unique effects of hepatic function, lipid metabolism bone and grouth endocrine parameters of estetrol in combined oral contraceptives.” Eur J Cont Reprod Health Care, 2015; 20(6):463-75.
-
Montt-Guevara MM et al. “Estetrol Modulated endotelial Nitric Oxid Synthesis in human endothelial Cells.” Front Endocrinol (Lausanne) 2015; 6: 111.
-
Pluchino N, et al. “Effect of Estetrol Administration on brain and serum Allopregnanolone in intact and ovariectomized rats.” J Steroid Biochem Steroid Mol Biol, 2014 sept; 143: 285-90.
-
Visser M, et al. “Clinical applications for estetrol.” J Steroid Biochem Mol Biol 2009 Mar; 114 (1-2): 85-9.



